REVISIÓN:
CLOSTRIDIOIDES DIFFICILE EN EL ÁMBITO QUIRÚRGICO
María San Basilio, Inés Rubio, Sara Gortázar, Carla Ramírez, Aurora Burgos, Mario Álvarez.
Servicios de Cirugía Pediátrica (1), Cirugía General y del Aparato Digestivo (2) y Aparato Digestivo (3), Hospital Universitario La Paz, Madrid, España.
Correspondencia: para contactar con la autora accionar aquí (María San Basilio).
Rev Acircal. 2022; 9 (1): 1-22.
Palabras clave: Clostridioides difficile, colitis pseudomembranosa, cirugía, colectomía, ileostomía.
Keywords: Clostridioides difficile, pseudomembranous colitis, surgery, colectomy, ileostomy.
.
Descargar artículo en PDF
Introducción:
En 2016 Lawson et al propusieron la reclasificación del Clostridium difficile como Clostritioides difficile, siendo aceptada la nueva denominación según el Código Internacional de Nomenclatura de Procariotas (1); sin embargo, esta reclasificación no invalida la nomenclatura previa por lo que actualmente ambos nombres pueden ser empleados (2). Clostridioides difficile (CD) es la principal causa de diarrea infecciosa nosocomial (otras causas de diarrea nosocomial como las asociadas a fármacos son más frecuentes), y una fuente importante de morbi-mortalidad para los pacientes ingresados. Por otro lado, las infecciones de origen comunitario representan actualmente hasta el 30% del total de infecciones por CD (3).
La infección por CD (ICD), frecuentemente causada por la exposición a antibióticos que alteran la microbiota del intestino, tiene una manifestación clínica variable que incluye desde diarrea leve hasta colitis fulminante. La patogenia de la ICD es de interés para los cirujanos ya que puede complicar el postoperatorio de pacientes quirúrgicos ingresados, y además porque los casos graves que no responden a tratamiento médico o que presentan complicaciones como necrosis, perforación o síndrome compartimental abdominal, pueden requerir tratamiento quirúrgico, en muchas ocasiones de forma urgente. Las indicaciones de cirugía y las opciones quirúrgicas en ocasiones no están suficientemente claras para los cirujanos digestivos y, de hecho, recientemente se han publicado los resultados de procedimientos novedosos, lo que hace que, a nuestro juicio, la revisión de esta patología resulte de interés.
Por otro lado, las medidas de prevención y control son fundamentales para evitar la diseminación intrahospitalaria.
El objetivo de esta revisión narrativa es actualizar el estado del conocimiento sobre la ICD con un enfoque eminentemente quirúrgico.
Material y métodos:
Se realizó una búsqueda exhaustiva de la literatura en las bases de datos Pubmed y Embase de trabajos publicadas en los últimos 15 años (2007-2022) para encontrar qué artículos eran los más adecuados. La estrategia de búsqueda consistió en utilizar los operadores booleanos OR y AND junto con los siguientes términos: Clostridium difficile, toxin a, toxin b, ileostomy y colectomy. Se realizaron búsquedas adicionales incluyendo: fecal microbiota transplantation, enterocolitis, pseudomembranous, toxic megacolon, bacterial spores.
Se seleccionaron publicaciones de tipo ensayo clínico, metaanaálisis, revisiones y revisiones sistemáticas en lengua inglesa y española. Se excluyeron casos clínicos y trabajos publicados en otras lenguas.
Además, se consultaron exhaustivamente las guías clínicas y recomendaciones sobre la infección y tratamiento de CD de diversas sociedades científicas como la World Society of Emergency Surgery (WSES, actualizadas en 2019) o la Infectious Diseases Society of America (IDSA).
La búsqueda bibliográfica, la revisión de los documentos seleccionados y la elección del contenido fueron realizados por todos los firmantes. Tras esta revisión se recogieron y sintetizaron de forma ordenada los conceptos y recomendaciones para facilitar la accesibilidad y consulta a la comunidad quirúrgica.
Resultados:
Epidemiología:
C. difficile forma parte de la flora cólica normal hasta en el 5% de los adultos sanos, aumentando a un 20-30% en ancianos y hospitalizados y hasta un 60% en recién nacidos (4).
A principios de los años 2000 se describió un aumento en la incidencia de la ICD que se relacionó con la aparición de cepas hipervirulentas (ribotipo 027, también conocido como NAP1/BI/027, (5)) y la introducción de los test diagnósticos de mayor sensibilidad (6). La incidencia de ICD nosocomial en España es de 171 casos por 100.000 ingresos y de 13,4 casos por 100.000 habitantes (7). Es más frecuente en mujeres, en personas de raza blanca y en mayores de 65 años (8).
El principal factor de riesgo para el desarrollo de ICD es el uso de antibióticos, tanto sistémicos como orales, aumentando el riesgo de infección hasta 10 veces (9). Con mayor frecuencia, están implicadas las fluoroquinolonas, la clindamicina y las cefalosporinas y penicilinas, aunque cualquier antibiótico puede predisponer a la ICD.
Otros factores de riesgo son el uso de inhibidores de la bomba de protones, el ingreso en UCI, la inmunodepresión, quimioterapia, las enfermedades gastrointestinales o las cirugías previas.
En cuanto a las cirugías, la ICD es más frecuente tras una cirugía urgente que tras una programada. Por orden de frecuencia las cirugías con mayor probabilidad de ICD en el postoperatorio son la colectomía, la resección de intestino delgado y la resección gástrica (10).
Una cirugía que con relativa frecuencia se complica con ICD es el cierre de ileostomía, que puede presentar ICD durante el postoperatorio en el 1,6% de los casos (11) y es más frecuente en cierres tardíos (> 6 meses desde el procedimiento índice) (12). Como medidas para disminuir esta incidencia se ha propuesto evitar los antibióticos perioperatorios y considerar cuidadosamente el momento de la cirugía, intentando no retrasarlo más allá de los 6 meses (13). Desde un punto de vista teórico se podría considerar la irrigación anterógrada del colon desde la ileostomía con vancomicina en casos de riesgo si se llegaran a definir con claridad.
Microbiología y fisiopatología:
C. difficile es un bacilo Gram positivo anaerobio productor de toxinas y formador de esporas, que forma parte de la flora intestinal habitual. Su presencia es bien tolerada en pacientes sanos, gracias a la regulación ejercida por la microbiota. Si este equilibrio se rompe, CD es capaz de proliferar y causar inflamación y daño cólico.
La transmisión se realiza por vía fecal-oral por medio de esporas aerotolerantes, resistentes a los desinfectantes de uso común, el calor, el ácido y a la mayoría de los antibióticos (14). Estas esporas pueden permanecer en el ambiente hospitalario, incluidas superficies inertes, manos, ropa de sanitarios, etc. Esta transmisión parece más probable a partir de pacientes con diarrea por ICD que por portadores asintomáticos. El ciclo infectante comienza con la ingesta de esporas que llegan hasta el colon, donde pueden unirse a las células epiteliales de la mucosa y permanecer latentes.
Si se produce un disbalance en la flora, por ejemplo, por el uso de antibióticos, se genera el entorno adecuado para que estas esporas germinen hasta la forma adulta metabólicamente activa y causen infección (15).
En su forma adulta, CD produce toxinas, siendo las más importantes en la patogénesis de la infección las exotoxinas A y B (16). De hecho, CD es muy raramente invasivo y las cepas no productoras de toxinas no general ICD. Estas toxinas, al unirse a receptores en la superficie de las células de la mucosa cólica provocan una fuerte respuesta inflamatoria y la disrupción de la mucosa y de sus uniones intercelulares aumentando la permeabilidad lo que produce daño tisular y diarrea. En general los niveles de toxinas correlacionan con la gravedad y la toxina B es más potente que la A. La cepa 027 produce niveles mucho mayores de toxinas y otras toxinas adicionales de acción no bien comprendida. Desde el punto de vista defensivo, se generan niveles variables de anticuerpos contra estas toxinas que confieren una protección variable.
Los niños menores de 2 años no tienen receptores para las toxinas y por eso es muy infrecuente que desarrollen colitis en la colonización por CD (4), (17).
Para finalizar el ciclo de infección de CD, la célula bacteriana adulta produce esporas que pueden ser diseminadas en las heces o permanecer en el colon del individuo y provocar recurrencias (18).
Clínica:
Las presentaciones clínicas más comunes de la ICD son (19):
- Diarrea: deposiciones blandas o acuosas con una frecuencia ≥3 deposiciones en menos de 24 horas.
- Íleo: disminución o ausencia de peristaltismo intestinal, con síntomas como náuseas, vómitos y ausencia de deposiciones.
- Megacolon tóxico: distensión del colon acompañado de signos de respuesta inflamatoria sistémica y fallo multiorgánico (20).
La Sociedad Europea de Microbiología y Enfermedades Infecciosas (ESCMID) clasifica la infección por CD en infección no grave e infección grave (21).
- La infección leve cursa con diarrea con dolor abdominal bajo y retortijones; por consenso de expertos asocia leucocitosis ≤ 15000 /ml y creatinina < 1.5mg/dl.
- La ESCMID define la infección grave como aquella que presenta un curso complicado con efectos tóxicos sistémicos significativos y shock, pudiendo resultar en ingreso en UCI, colectomía o muerte.
Típicamente se ha hecho distinción entre colitis grave y colitis fulminante, pero con frecuencia resulta difícil situar el límite entre ambas entidades, por lo que en la actualidad se prefiere englobarlas bajo el término de colitis grave. Se hablaba de fulminante cuando había shock, íleo o megacolon y representa 2-3% del total de los cuadros de ICD.
La infección grave cursa con diarrea, dolor abdominal bajo grave o difuso, distensión abdominal y suele acompañarse de los siguientes factores de mal pronóstico: fiebre >38,5ºC, hipoalbuminemia, hipovolemia, aumento del nivel de creatinina sérica (≥1.5mg/dl), leucocitosis marcada (>15.000/ml) o lactato sérico elevado (22).
Las manifestaciones extracólicas de la ICD son raras. Pueden presentarse en forma de ileitis, apendicitis, artritis reactiva, celulitis y bacteriemia. Son más frecuentes en pacientes con manipulación quirúrgica del tracto gastrointestinal (23).
Diagnóstico:
El diagnóstico de la ICD debe basarse en la combinación de signos y síntomas típicos con pruebas de laboratorio, siendo los test serológicos la piedra angular del diagnóstico. Según la ESCMID se puede hablar de infección ICD cuando se cumpla al menos uno de los siguientes criterios (24):
- Clínica compatible asociada a demostración de toxina libre o de difficile productor de toxinas en heces, en ausencia de otra causa evidente.
- Demostración de pseudomembranas en colonoscopia o tras la colectomía.
1) Diagnóstico serológico:
Está indicado en pacientes con factores de riesgo para CD y clínica compatible sin otra causa evidente. El cribado de pacientes asintomáticos no está indicado y tampoco repetir las pruebas para confirmar la erradicación (25).
El cultivo de cepas toxigénicas se considera el Gold Standard y tiene gran sensibilidad, pero no es una prueba útil en el ámbito clínico ya que los resultados tardan hasta 7 días.
Se emplean técnicas de inmunoanálisis para la detección rápida de la toxina A y/o B y la enzima glutamato deshidrogenasa (GDH), obteniendo resultados en pocas horas. La enzima GDH está presente en todas las cepas de CD, pero tiene el inconveniente de no distinguir entre cepas toxigénicas y no toxigénicas.
Las pruebas moleculares de amplificación de ácidos nucleicos, como la PCR, permiten realizar la detección de los genes que codifican las toxinas A y B. El inconveniente principal de este método es que no analiza la producción activa de toxinas y que su alta sensibilidad puede llevar al sobrediagnóstico (26).
La guía de la Sociedad Española de Microbiología (27) (ver figura 1) recomienda un algoritmo diagnóstico en dos pasos. Se comienza con la detección de la enzima GDH y si se obtiene un resultado positivo se realiza un inmunoanálisis de toxinas A/B. Las muestras con un segundo resultado positivo se pueden informar como positivas para ICD. Una alternativa es analizar las muestras con un test combinado de enzima GDH y toxina A/B. Cuando se obtengan resultados positivos o negativos concordantes se pueden informar como tales. Las muestras en las que los resultados no concuerden deberán ser analizadas con técnicas moleculares (PCR).
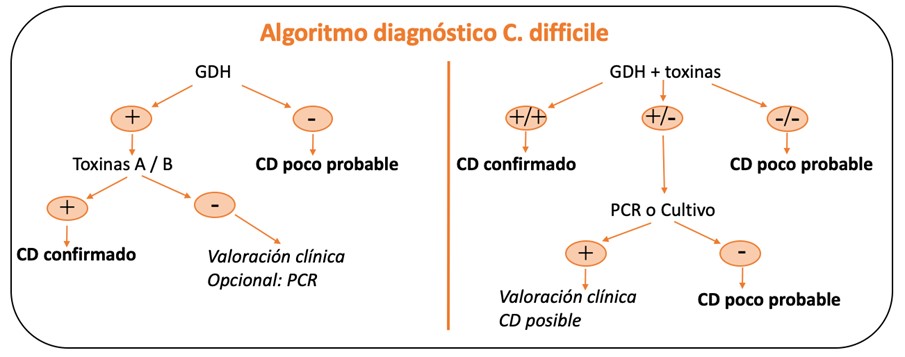
Figura 1: Algoritmo diagnóstico de CD según las recomendaciones de la Sociedad Española de Microbiología.
2) Pruebas de imagen:
En pacientes con ICD grave puede estar indicado el uso de TC con contraste intravenoso para descartar complicaciones cómo megacolon tóxico (dilatación del colon de > 7cm) o perforación intestinal que pueden precisar una intervención quirúrgica urgente.
Los hallazgos más frecuentes incluyen engrosamiento mural del colon (puede verse como el signo del “doble halo” o “signo de la diana”, que consiste en 2 o 3 anillos concéntricos con diferentes valores de atenuación.) (ver imagen 1), cambios en la grasa pericólica y ascitis. El «signo del acordeón», es muy sugestivo de colitis pseudomembranosa. Para poder observar esta imagen del acordeón hay que administrar contraste por vía oral, que queda atrapado entre los pliegues haustrales edematizados (28). Es indicativo de edema severo en el colon por lo que también puede aparecer en enfermedad de Crohn o colitis isquémica.
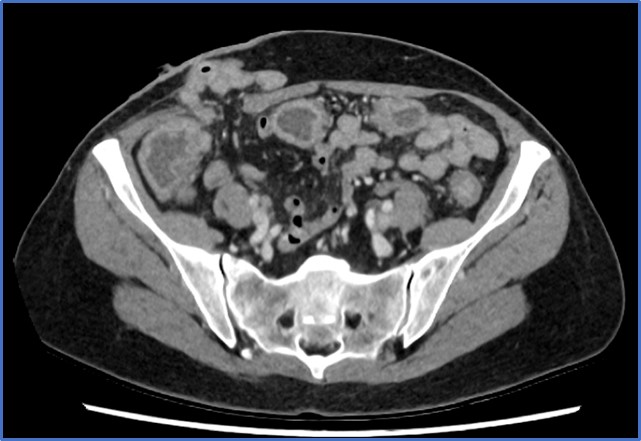
Imagen 1: Imagen de TC de paciente con ileostomía que desarrolló infección por CD en la que se observa el “signo del halo” o “signo de la diana”.
3) Endoscopia:
No está indicada de forma rutinaria, pero puede resultar útil en casos en los que haya una fuerte sospecha a pesar de un resultado de laboratorio negativo, o en pacientes en los que no se pueden recoger muestras de heces, cómo aquellos con íleo. Se prefiere la sigmoidoscopia flexible con insuflación mínima o nula de aire para evitar la perforación del colon inflamado (29).
La endoscopia puede mostrar eritema, edema o erosiones inespecíficas, pero es normal hasta en un 6-31% de los pacientes con ICD. La lesión característica de la ICD es la colitis pseudomembranosa (ver imagen 2), presente en el 40-60% de los casos. Su presencia no se relaciona con la severidad del cuadro. Las pseudomembranas son placas sobreelevadas amarillentas formadas por fibrina y detritus celulares que pueden desprenderse dejando áreas de mucosa denudada (30).
Diagnóstico diferencial:
Es importante distinguir ICD de otras causas de diarrea ya que no todo paciente con tratamiento antibiótico que debuta con una diarrea tiene una ICD. El diagnóstico diferencial es complejo. En la mayoría de los casos la causa es osmótica, puramente medicamentosa y/o por disbacteriosis, y no se trata de una diarrea infecciosa. En estos pacientes la diarrea se detendrá cuando cese la ingesta del medicamento pudiendo ser eficaz también añadir probióticos en los casos indicados.
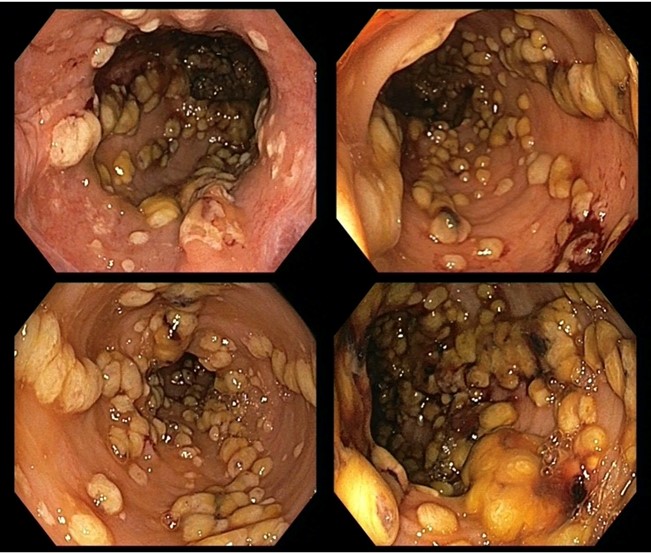
Imagen 2: Hallazgo de pseudomembranas en sigmoidoscopia en pacientes con ICD.
La presencia de fiebre o leucocitosis nos orienta a una causa infecciosa. Habrá que tener en cuenta otros organismos que pueden causar diarrea infecciosa asociada a antibióticos como S. aureus, Klebsiella oxytoca, Clostridium perfingens y Salmonella spp. (31) Las manifestaciones clínicas son similares a las de la ICD por lo que el diagnóstico se realiza por el cultivo de heces.
Tratamiento médico:
El primer paso en el tratamiento de la ICD es la interrupción del antibiótico desencadenante lo antes posible, junto con la implementación de medidas de prevención de la diseminación y la instauración de un tratamiento antibiótico eficaz frente a CD.
No está indicado tratar pacientes asintomáticos ya que las esporas son resistentes a la antibioterapia y no se logra acabar con el estado de portador (32).
1) Antibioterapia:
La elección del antibiótico debe hacerse en función de la gravedad clínica y el riesgo de recidiva, siendo los más empleados vancomicina y fidaxomicina y en segunda línea metronidazol (33). Los dos primeros no presentan absorción intestinal por lo que alcanzan concentraciones cólicas elevadas sin toxicidad sistémica. Algunas guías como las de la IDSA (Infectious Diseases Society of America) recomiendan más fidaxomicina que vancomicina, pero esta recomendación no es universal. El metronidazol es absorbido por vía intestinal con una biodisponibilidad del 90% distribuyéndose ampliamente por diferentes tejidos (34). Deben evitarse ciclos repetidos o prolongados debido al riesgo de neurotoxicidad acumulativa y potencialmente irreversible (20). En la colitis fulminante suelen combinarse vancomicina oral y metronidazol intravenoso.
Si el paciente presenta íleo paralítico o no tolera la vía oral es recomendable añadir al tratamiento metronidazol intravenoso o hacer instilaciones de vancomicina por vía rectal (35). Se han detectado ya cepas de CD resistentes a metronidazol y otros antibióticos, lo que puede tener importantes implicaciones para el éxito del tratamiento.
2) Otros tratamientos:
El nivel de respuesta inmune y de producción de IgG contra CD es un determinante de la magnitud y duración de las manifestaciones clínicas. En pacientes con hipogammaglobulinemia la inmunización pasiva con inmunoglobulina intravenosa es un complemento útil (32).
Bezlotoxumab es un anticuerpo monoclonal que neutraliza la toxina B y ha demostrado ser beneficioso en el tratamiento y prevención de recurrencias. Una dosis intravenosa de 10mg por kilogramo de peso, administrada junto con antibioterapia dirigida, reduce la incidencia de recurrencias en las primeras 12 semanas hasta un 51% (36). Se recomienda sobre todo ante cuadros recurrentes.
3) Trasplante fecal:
Una microbiota sana permite la exclusión competitiva de patógenos que residen habitualmente en el lumen intestinal. Los pacientes con ICD recurrente tienen una diversidad reducida del microbioma intestinal (37).
El trasplante de microbiota fecal consiste en realizar instilaciones de heces procesadas recogidas de un donante sano en el tracto intestinal de un paciente con ICD recurrente. Es un tratamiento relativamente novedoso y con el que aún no se tiene experiencia en todos los centros. Tiene un papel bien definido en el tratamiento de la ICD recurrente, y cada vez hay mayor evidencia de su eficacia en la infección grave (38). Actualmente está indicado en aquellos pacientes con 3 o más recurrencias de ICD o en aquellos con un segundo episodio cuando tanto la primera como la segunda infección hayan requerido hospitalización. No está recomendado para un primer episodio de ICD (39). Suele corregir la clínica en 36-48 horas. Existen ya bancos de heces internacionales con protocolos de cribado para la selección de donantes.
Las complicaciones asociadas al trasplante fecal detectadas hasta la fecha se han asociado a la presencia de bacterias multirresistentes no detectadas, que condicionaron infecciones graves en el receptor (40) y que han hecho que se depuren aún más los protocolos de aislamiento.
Tratamiento quirúrgico:
La decisión de intervenir a un paciente con una infección grave por CD que precisa cirugía ha de tomarse con prontitud, ya que está demostrado que la indicación de tratamiento quirúrgico precoz en pacientes con colitis fulminante aumenta la supervivencia. Así, por ejemplo, cuando los pacientes son intervenidos necesitando ya soporte vasoactivo aumenta la mortalidad.
Sailhamer observó que los índices de supervivencia de pacientes con colitis fulminante por CD eran mayores cuando estos estaban ingresados en servicios quirúrgicos que en servicios médicos, ya que eran intervenidos de manera más precoz (41).
No obstante, también hay que reflejar que el tratamiento quirúrgico tiene una mortalidad postoperatoria del 25-30%, sin evidenciarse diferencias significativas entre las distintas técnicas quirúrgicas (42), en gran parte por la situación de los pacientes cuando se indica la cirugía.
A) Indicaciones de cirugía:
Aunque la mayoría de los pacientes con ICD responden de manera favorable al tratamiento médico, es importante hacer una valoración quirúrgica en aquellos que presenten infección grave o que no respondan al tratamiento óptimo administrado durante 48h.
La indicación de cirugía en la ICD se puede sentar por:
- Complicaciones intraabdominales de la colitis: síndrome compartimental abdominal, necrosis transmural o perforación cólica.
- Infección grave progresiva o refractaria: sepsis, hipotensión mantenida, íleo o distensión abdominal significativa y refractarios al tratamiento médico, estado mental alterado, fallo renal, distrés respiratorio, acidosis láctica (>5mmol/L) o leucocitosis ≥50.000 células/ml. (22), (29).
B) Técnica quirúrgica:
La técnica quirúrgica dependerá de la gravedad de las complicaciones asociadas a la colitis. La colectomía abdominal subtotal es hoy en día el gold standard, pero algunos pacientes seleccionados pueden beneficiarse de la realización de una ileostomía de derivación con lavado cólico anterógrado intraoperatorio con PEG (polietilenglicol) y posteriores instilaciones de vancomicina a través de la ileostomía (43).
B.1) Colectomía subtotal
Es el tratamiento quirúrgico gold standard en el paciente con infección grave por CD. El objetivo de la cirugía es el control del foco (colectomía subtotal) y la reducción del inóculo (lavado abundante de la cavidad en caso de peritonitis purulenta o fecaloidea). Las resecciones cólicas parciales no han demostrado mejores resultados (3), (22). Estará indicada siempre en caso de perforación, necrosis transmural o síndrome compartimental.
Aunque el abordaje laparoscópico no está formalmente contraindicado, la realidad es que la distensión cólica y la inestabilidad clínica del paciente, hacen que el abordaje más habitual sea el laparotómico, y que, al estar el colon tan distendido, una laparotomía xifo-pubiana sea aconsejable. (44)
Estas cirugías ocurrirán de urgencia/ urgencia programada, por lo que un marcaje formal del sitio del estoma por un estomaterapéuta es poco probable. Por ello el cirujano general debe conocer los principios básicos del marcaje de estomas y aplicarlos en estos pacientes en la medida que sea posible.
Tras la laparotomía se debe valorar la presencia de líquido purulento o fecaloideo en la cavidad abdominal, explorando los cuatro cuadrantes y realizándose toma de muestra del líquido peritoneal para cultivo.
El aspecto macroscópicamente normal del colon no debe disuadir al equipo quirúrgico de realizar una resección, ya que, al ser una enfermedad de la mucosa, la serosa puede parecer intacta y llevar erróneamente a resecar una porción de colon menor a la afectada (8), (45).
La resección comprenderá desde el íleon terminal hasta el recto alto, realizando una ileostomía terminal. Existen discrepancias en el nivel de la sección distal, si hacerla en la unión rectosigmoidea o incluir el recto intraabdominal quedando a criterio del cirujano. Lo más habitual es dejar todo el recto porque no parece empeorar la evolución y porque en vistas a una ulterior reconstrucción del tránsito ofrecerá mejores resultados funcionales. No es recomendable la realización de una anastomosis quirúrgica en este contexto (44). La colectomía subtotal no será oncológica, por lo que no es necesario seccionar el meso en su base y se podrá realizar la sección del meso justo en el borde mesentérico.
En casos excepcionales de resucitaciones con fluidoterapia muy agresivas, que pueden condicionar un síndrome compartimental abdominal, se aplicarán los principios de la cirugía de control de daños, pudiendo dejar el cabo de íleon suelto en cavidad abdominal y usar un cierre temporal de pared con sistema de vacío. Al cabo de 24-48h se revisaría la cavidad y se procedería a la confección de una ileostomía terminal. Se debe evitar un abdomen abierto, si no es estrictamente necesario.
Para evitar la persistencia de la ICD en el recto residual se pueden realizar enemas de vancomicina durante el postoperatorio (46).
B.2) Ileostomía de derivación con lavado cólico anterógrado:
Se trata de un procedimiento relativamente novedoso y por tanto con menor aval de la literatura y la experiencia. Este procedimiento permite la reconstrucción del tránsito en un segundo tiempo hasta en un 80% de los casos, pero solo es aplicable a una pequeña proporción de pacientes. Aunque hay numerosos estudios describiendo el empleo de esta técnica, la realidad es que aún no hay guías que expongan de forma clara cuándo está indicado elegirla. Sí que coinciden en que está contraindicada en pacientes con necrosis o perforación cólica, así como en pacientes que presenten un síndrome compartimental intraabdominal (42), (47). Como mencionábamos antes, es importante no dejarse llevar por el aspecto macroscópico del colon para indicar esta cirugía, ya que no muestra la afectación de la mucosa.
La Surgical Infection Society publicó en 2022 una guía en la que declaraba aún la colectomía subtotal como gold standard. Exponen que la preservación del colon mediante ileostomía en asa de derivación podría considerarse en pacientes seleccionados (sin precisar exactamente los criterios de selección) y puede estar asociado con tasas más altas de reversión de la ostomía o restauración de la continuidad gastrointestinal, pero puede conducir a desarrollo de colitis recurrente por CD. La severidad de la enfermedad en el momento de la consulta, la preferencia del paciente y las comorbilidades del paciente pueden influir en la decisión del cirujano para realizar una colectomía subtotal. (48)
En la literatura que compara este procedimiento con la colectomía, es importante revisar las características de los pacientes y no pensar que los mejores resultados puedan deberse solo a la técnica en sí, pues los pacientes sometidos a ella pueden tener cuadros menos complicados.
Como resulta lógico, generalmente la respuesta clínica es más lenta que con cirugías exeréticas.
El abordaje puede ser laparoscópico o abierto según la preferencia del cirujano y la capacidad del paciente para tolerar el neumoperitoneo (21). Neal et al, recomiendan la creación de una ileostomía en asa a 20-40 cm de la válvula ileocecal. Se inserta un catéter urinario en la rama eferente de la ileostomía hasta el ciego. Posteriormente se instilan ocho litros de solución de polietilenglicol (Movicol®, Moviprep®), que se recogen mediante un tubo rectal (49) (ver figura 2).
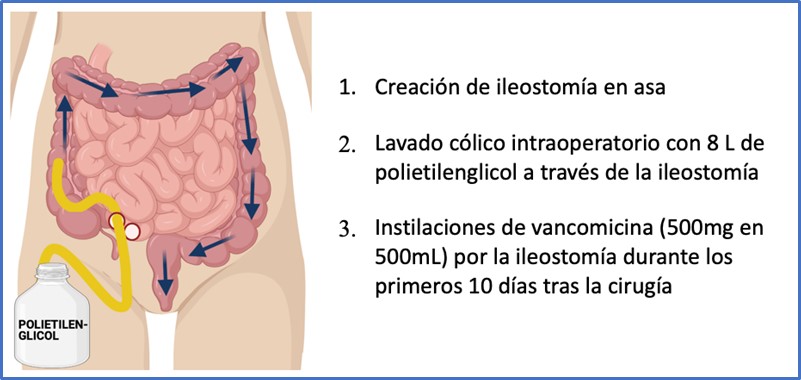
Figura 2: Ileostomía de derivación con lavado cólico anterógrado intraoperatorio.
En el postoperatorio se realizan instilaciones de vancomicina (500mg en 500ml de solución Ringer Lactato) a través del asa eferente de la ileostomía 3 veces al día durante 7-10 días y se administra metronidazol intravenoso concomitante (49).
Una complicación rara (alrededor del 5%) pero grave y que generalmente ocurre dentro de las primeras 48 horas es el síndrome compartimental abdominal. Este riesgo se puede reducir muy levemente con la colocación de un drenaje intraperitoneal aspirativo tipo Blake.
Si no existe mejoría en las siguientes 48 horas a la intervención, hay que considerar realizar una colectomía subtotal.
Es importante explicar al paciente que al mantener el colon intacto sigue existiendo riesgo de recurrencia, especialmente al cerrar la ileostomía y reconstruir el tránsito (50).
Recurrencia:
Se habla de ICD recurrente cuando los síntomas reaparecen en las primeras 2-8 semanas. Hasta el 25% de los pacientes que inicialmente responden a la antibioterapia experimentan la primera recurrencia dentro de los primeros 30 días.
Los factores de riesgo de recurrencia incluyen edad > 65 años, necesidad de tratamiento continuo con antibióticos concomitantes, recurrencias previas, infección por cepas hipervirulentas de CD, supresión del ácido gástrico, insuficiencia renal, estancias hospitalarias prolongadas e inmunodeficiencia (51).
Prevención:
Los esfuerzos para prevenir la ICD deben centrarse en dos objetivos: reducir la susceptibilidad del paciente y prevenir la transmisión del organismo.
Los programas de administración de antibióticos que fomentan el uso dirigido y la minimización del uso de clindamicina y fluoroquinolonas han sido eficaces reduciendo la incidencia de ICD.
Los sanitarios son importantes vectores en la transmisión de CD. Las esporas son resistentes al etanol y la clorhexidina, por lo que los agentes de desinfección utilizados comúnmente resultan ineficaces. Ante la sospecha de ICD se debe aislar al paciente y todo el personal sanitario en contacto con él debe realizar higiene de manos con agua y jabón. Se pueden usar desinfectantes como lejía y Virkon™ (desinfectante virucida de amplio espectro activo para virus, bacterias y hongos compuesto de Bis -peroximonosulfato- bis -sulfato- de pentapotasio, compuestos peroxidados, tensioactivos y ácidos orgánicos) (52). Las esporas pueden permanecer en la piel de los pacientes hasta 7 días después del final de la diarrea, por lo que hay que mantener las medidas de aislamiento hasta entonces.
Para evitar la transmisión tras el alta hospitalaria, en el domicilio los pacientes deben lavarse las manos con agua y jabón frecuentemente y evitar usar el mismo baño que sus convivientes. Las áreas del baño y la cocina se deben limpiar con lejía (52).
Las principales medidas de prevención primaria en desarrollo son:
- Ribaxamasa: es una β-lactamasa oral que degrada los antibióticos β-lactámicos. Al administrarse junto a la antibioterapia reduce el daño sobre la microbiota intestinal (53).
- Inoculación con cepas no toxigénicas: logran una respuesta inmune frente a CD con la consecuente memoria inmunológica. (54)
- Vacuna toxoide: estimula la inmunidad frente a las toxinas A y B y anula sus efectos nocivos (55).
Desde el punto de vista farmacológico se ha planteado la prevención secundaria con vancomicina oral en pacientes con alto riesgo de ICD recurrente (>65 años, antecedente de ICD grave o inmunosupresión) que requieren ciclos prolongados de antibióticos sistémicos. Los probióticos no parecen ser útiles en este contexto.
Discusión:
El aumento de la incidencia y gravedad de la infección por CD tanto en la población general como en poblaciones de pacientes quirúrgicos lo convierte en un importante desafío para los servicios quirúrgicos. Los cirujanos se enfrentan a dos tipos de pacientes con ICD: aquellos en los que desencadenan la enfermedad por intervenciones no relacionadas y el uso de antibióticos y aquellos en los que la enfermedad requiere tratamiento quirúrgico.
El diagnóstico precoz es primordial para el manejo efectivo de la ICD, permitiendo la implementación inmediata de medidas de aislamiento y la optimización del tratamiento. La mayoría de los pacientes responden al tratamiento médico con antibióticos, pero en una pequeña fracción de los pacientes es necesario el tratamiento quirúrgico, que no debe retrasarse cuando la enfermedad es grave, ya que esto aumenta la mortalidad.
Existen nuevas alternativas terapéuticas como el trasplante de microbiota y otras que como cirujanos debemos conocer como la ileostomía derivativa con lavado anterógrado para casos seleccionados que puede permitir preservar el órgano diana. Al tratarse de una técnica novedosa aún no hay indicaciones claras al respecto. En general se entiende que la colectomía subtotal sigue siendo el gold standard y nunca se debe retrasar en pacientes graves que presenten perforación, necrosis transmural o síndrome compartimental. En este artículo se hace mención a varios trabajos que comparan las dos técnicas, pero todos tienen un sesgo importante de selección ya que los pacientes más graves siempre reciben colectomía subtotal.
En el estudio de Neal et al. de 2011 se compararon 42 pacientes sometidos a ileostomía en asa de derivación con lavado anterógrado con una cohorte histórica de 42 pacientes sometidos a colectomía abdominal total (49). La mortalidad fue menor en pacientes sometidos a ileostomía en asa (8 [19 %] frente a 21 [50 %]; p = 0,006). Ferrada et al. (47) realizaron un estudio multicéntrico retrospectivo en 2017 llegando a conclusiones similares. 98 pacientes fueron identificados: 67 (79%) se sometieron a una colectomía abdominal total, mientras que 21 (21%) se sometieron a una ileostomía en asa de derivación. La mortalidad ajustada fue menor en el grupo de ileostomía en asa de derivación (17 % frente a 40 %; p = 0,002). Como hemos mencionado, estas diferencias en la mortalidad probablemente se deban a un sesgo de selección de pacientes, siendo los de la colectomía total precisamente los más graves desde el principio.
Por otro lado, en 2017, Fashandi et al. (50) realizaron un estudio de cohortes retrospectivo con un total de 23 pacientes intervenidos por ICD: 13 (57%) se sometieron a colectomía subtotal y 10 (43%) a ileostomía en asa de derivación. No hubo diferencias significativas en la mortalidad entre ambos grupos ni diferencias en la frecuencia de pacientes que se sometieron a un procedimiento para devolver la continuidad intestinal (p = 0,27). Se observó también qué entre los pacientes sometidos a ileostomía en asa de derivación, el 40% tuvo un episodio de infección recurrente después de la restauración de la continuidad intestinal.
En el futuro habrá que realizar estudios aleatorizados para intentar establecer unos criterios de selección de pacientes para la ileostomía de derivación, que, siendo una técnica que puede conllevar ventajas cómo mayor tasa de restablecimiento del tránsito, no debe sobreindicarse por la severidad de esta patología y la potencial gravedad de posibles recurrencias.
Conclusiones:
La prevención de la ICD comienza con la educación de los profesionales sanitarios en cuanto a medidas preventivas, como el lavado de manos con agua y jabón o la optimización del uso de antibióticos.
Los cirujanos debemos conocer la patología de la ICD tanto por su frecuente aparición en nuestros pacientes, muy relacionada con nuestros cuidados, así como por la existencia de un porcentaje pequeño de pacientes con ICD en los que el tratamiento quirúrgico puede salvarles la vida.
Declaraciones y conflicto de intereses: Este manuscrito ha sido revisado y aprobado por todos los autores para su publicación. No tiene conflicto de intereses con la revista ACIRCAL y/o con la industria. No ha sido presentado en ninguna reunión ni congreso ni se ha publicado o se está considerando su publicación en otro lugar.
Referencias bibliográficas:
1. P.A. Lawson, D.M. Citron, K.L. Tyrrell, S.M. Finegold. Reclassification of Clostridium difficile as Clostridioides difficile (Hall and O’Toole 1935) Prévot 1938. Anaerobe 40 (2016) 95–99.
- Oren A, Rupnik M. Clostridium difficile and Clostridioides difficile: Two validly published and correct names. Anaerobe. 2018 Aug;52:125-126.
- McDonald LC, Gerding DN, Johnson S, Bakken JS, Carroll KC, Coffin SE, et al. Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 2018;66(7):987–94.
- Jangi S, Lamont JT. Asymptomatic colonization by clostridium difficile in infants: Implications for disease in later life. J Pediatr Gastroenterol Nutr. 2010;51(1):2–7.
- Hookman P, Barkin JS. Clostridium difficile associated infection, diarrhea and colitis. World J Gastroenterol. 2009 Apr 7;15(13):1554-80. doi: 10.3748/wjg.15.1554. PMID: 19340897; PMCID: PMC2669939.
- Guh A, Mu Y, Winston L, Johnston H, Olson D, Farley MM, et al. Trends in U.S. Burden of Clostridioides difficile Infection and Outcomes. N Engl J Med. 2020;382:1320–30.
- Asensio A, Monge D. Epidemiología de la infección por Clostridium difficile en España. Enferm Infecc Microbiol Clin. 2012;30(6):333–7.
- Lessa F, Yi Mu W, Bamberg W, Beldavs Z, Dumyati G, Dunn J. Burden of Clostridium difficile Infection in the United States. N Engl J Med. 2015;372(9):825–34.
- Vardakas KZ, Trigkidis KK, Boukouvala E, Falagas ME. Clostridium difficile infection following systemic antibiotic administration in randomised controlled trials: a systematic review and meta-analysis. Int J Antimicrob Agents. 2016;48(1):1–10.
- Sartelli M, Di Bella S, McFarland L V., Khanna S, Furuya-Kanamori L, Abuzeid N, et al. 2019 update of the WSES guidelines for management of Clostridioides (Clostridium) difficile infection in surgical patients. World J Emerg Surg. 2019;14(1):1–29.
- Wilson MZ, Hollenbeak CS, Stewart DB. Impact of clostridium difficile colitis following closure of a diverting loop ileostomy: Results of a matched cohort study. Color Dis. 2013;15(8):974–81.
- Rubio-Perez I, Leon M, Pastor D, Dominguez JD, Cantero R. Increased postoperative complications after protective ileostomy closure delay: An institutional study. World J Gastrointest Surg. 2014;6(9):169.
- Harries RL, Ansell J, Codd RJ, Williams GL. A systematic review of Clostridium difficile infection following reversal of ileostomy. Colorectal Dis. 2017 Oct;19(10):881-887.
- Zerey M, Paton BL, Lincourt AE, Gersin KS, Kercher KW, Heniford BT. The burden of Clostridium difficile in surgical patients in the United States. Surg Infect (Larchmt). 2007;8(6):557–66.
- Shen A. Clostridioides difficile Spores: Bile Acid Sensors and Trojan Horses of Transmission. Clin Colon Rectal Surg. 2020;33(2):58–66.
- Dembek M, Willing SE, Hong HA, Hosseini S, Salgado PS, Cutting SM. Inducible expression of spo0A as a universal tool for studying sporulation in Clostridium difficile. Front Microbiol. 2017;8(SEP):1–12.
- Riley T V., Collins DA, Karunakaran R, Kahar MA, Adnan A, Hassan SA, et al. High prevalence of toxigenic and nontoxigenic clostridium difficile strains in Malaysia. J Clin Microbiol. 2018;56(6):1–7.
- Mullish BH, Williams HRT. Clostridium diffi cile infection and antibiotic-associated diarrhoea. Clin Med J R Coll Physicians London. 2018;18(3):237–41.
- Kaiser AM, Hogen R, Bordeianou L, Alavi K, Wise PE, Sudan R. Clostridium Difficile Infection from a Surgical Perspective. J Gastrointest Surg. 2015;19(7):1363–77.
- Kelly CP, LaMont JT. Clostridium difficile-more difficult than ever. N Engl J Med 2008; 359:1932.
- Debast SB, Bauer MP, Kuijper EJ, Allerberger F, Bouza E, Coia JE, et al. European society of clinical microbiology and infectious diseases: Update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect. 2014;20(S2):1–26.
- Lamontagne F, Labbé AC, Haeck O, Lesur O, Lalancette M, Patino C, et al. Impact of emergency colectomy on survival of patients with fulminant Clostridium difficile colitis during an epidemic caused by a hypervirulent strain. Ann Surg. 2007;245(2):267–72.
- Gupta A, Patel R, Baddour LM, Pardi DS, Khanna S. Extraintestinal clostridium difficile infections: A single-center experience. Mayo Clin Proc. 2014;89(11):1525–36.
- Crobach MJT, Planche T, Eckert C, Barbut F, Terveer EM, Dekkers OM, et al. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect. 2016;22:S63–81.
- Aichinger E, Schleck CD, Harmsen WS, et al. Nonutility of repeat laboratory testing for detection of Clostridium difficile by use of PCR or enzyme immunoassay. J Clin Microbiol 2008; 46:3795.
- Carroll KC, Mizusawa M. Laboratory Tests for the Diagnosis of Clostridium difficile. Clin Colon Rectal Surg. 2020;33:73–81.
- Alcalá-hernández L, Mena-ribas A, Niubó-Bosh J, Marín-Arriaza M. Diagnóstico microbiológico de la infección por Clostridium difficile. Enferm Infecc Microbiol Clin. 2016;34(9):595–602. http://doi.org/10.1016/j.eimc.2015.09.004.
- Valiquette L, Pépin J, Do XV, Nault V, Beaulieu AA, Bédard J, et al. Prediction of complicated clostridium difficile infection by pleural effusion and increased wall thickness on computed tomography. Clin Infect Dis. 2009;49(4):554–60.
- Butala P, Divino CM. Surgical aspects of fulminant Clostridium difficile Colitis. Am J Surg. 2010;200(1):131–5.
- Velarde Ruiz-Velasco JA, Aldana-Ledesma JM, Ibarra-Estrada MA, Aguirre Díaz SA, Fernández-Ramírez JA, Cárdenas-Lara F, et al. Clinical and endoscopic features in patients with hospital-acquired diarrhea associated with Clostridium difficile infection. Rev Gastroenterol Mex. 2017;82(4):301–8.
- Polage CR, Solnick JV, Cohen SH. Nosocomial diarrhea: evaluation and treatment of causes other than Clostridium difficile. Clin Infect Dis. 2012 Oct;55(7):982-9.
- Sartelli M, Di Bella S, McFarland L V., Khanna S, Furuya-Kanamori L, Abuzeid N, et al. 2019 update of the WSES guidelines for management of Clostridioides (Clostridium) difficile infection in surgical patients. World J Emerg Surg. 2019;14(1):1–29.
- Bouza E, Aguado JM, Alcalá L, Almirante B, Alonso-Fernández P, Borges M, et al. Recommendations for the diagnosis and treatment of clostridioides difficile infection: An official clinical practice guideline of the spanish society of chemotherapy (SEQ), spanish society of internal medicine (SEMI) and the working group of postoperative. Rev Esp Quimioter. 2020;33(2):151–75.
- Dingsdag SA, Hunter N. Metronidazole: an update on metabolism, structure-cytotoxicity and resistance mechanisms. J Antimicrob Chemother. 2018;73(2):265–79.
- Fawley J, Napolitano LM. Vancomycin Enema in the Treatment of Clostridium difficile Infection. Surg Infect (Larchmt). 2019;20(4):311–6.
- Wilcox MH, Gerding DN, Poxton IR, Kelly C, Nathan R, Birch T, et al. Bezlotoxumab for Preventing Recurrent Clostridium difficile Infections. N Engl J Med. 2017;376(4):305–17.
- Ju YC, Antonopoulos DA, Kalra A, Tonelli A, Khalife WT, Schmidt TM, et al. Decreased diversity of the fecal microbiome in recurrent Clostridium difficile-associated diarrhea. J Infect Dis. 2008;197(3):435–8.
- van Nood E, Vrieze A, Nieuwdorp M, Fuentes S, Zoetendal EG, de Vos WM, et al. Duodenal Infusion of Donor Feces for Recurrent Clostridium difficile . N Engl J Med. 2013;368(5):407–15.
- Allegretti JR, Mullish BH, Kelly C, Fischer M. The evolution of the use of faecal microbiota transplantation and emerging therapeutic indications. Lancet. 2019;394(10196):420–31.
- Cheng YW, Fischer M. Fecal Microbiota Transplantation: Redefining Surgical Management of Refractory Clostridium difficile Infection. Clin Colon Rectal Surg. 2020;33(2):92–7.
- Sailhamer EA, Carson K, Chang Y, Zacharias N, Spaniolas K, Tabbara M, et al. Fulminant Clostridium difficile Colitis: Patterns of Care and Predictors of Mortality. Arch Surg. 2009;144(5):433–9.
- Felsenreich DM, Gachabayov M, Rojas A, Latifi R, Bergamaschi R. Meta-analysis of postoperative mortality and morbidity after total abdominal colectomy versus loop ileostomy with colonic lavage for fulminant clostridium difficile colitis. Dis Colon Rectum. 2020;9:1317–26.
- Vely A, Ferrada P. Role of Surgery in Clostridium difficile Infection. Clin Colon Rectal Surg. 2020;33(2):87–91.
- Stewart DB, Hollenbeak CS, Wilson MZ. Is colectomy for fulminant Clostridium difficile colitis life saving? A systematic review. Color Dis. 2013;15(7):798–804.
- Kulaylat AS, Kassam Z, Hollenbeak CS, Stewart DB. A surgical Clostridium-associated risk of death score predicts mortality after colectomy for Clostridium difficile. Dis Colon Rectum. 2017;60(12):1285–90.
- Van Der Wilden GM, Subramanian MP, Chang Y, Lottenberg L, Sawyer R, Davies SW, et al. Antibiotic Regimen after a Total Abdominal Colectomy with Ileostomy for Fulminant Clostridium difficile Colitis: A Multi-Institutional Study. Surg Infect (Larchmt). 2015;16(4):455–60.
- Ferrada P, Callcut R, Zielinski MD, Bruns B, Yeh DD, Zakrison TL, et al. Loop ileostomy versus total colectomy as surgical treatment for Clostridium difficile -associated disease: An Eastern Association for the Surgery of Trauma multicenter trial. J Trauma Acute Care Surg. 2017;83(1):36–40.
- Forrester JD, Colling KP, Diaz JJ, Faliks B, Kim PK, Tessier JM, Tung J, Huston JM. Surgical Infection Society Guidelines for Total Abdominal Colectomy versus Diverting Loop Ileostomy with Antegrade Intra-Colonic Lavage for the Surgical Management of Severe or Fulminant, Non-Perforated Clostridioides difficile Colitis. Surg Infect (Larchmt). 2022 Mar;23(2):97-104.
- Neal MD, Alverdy JC, Hall DE, Simmons RL, Zuckerbraun BS. Diverting loop ileostomy and colonic lavage: An alternative to total abdominal colectomy for the treatment of severe, complicated clostridium difficile associated disease. Ann Surg. 2011;254(3):423–9.
- Fashandi AZ, Martin AN, Wang PT, et al. An institutional comparison of total abdominal colectomy and diverting loop ileostomy and colonic lavage in the treatment of se- vere, complicated Clostridium difficile infections. Am J Surg 2017;213:507–511.
- Song JH, Kim YS. Recurrent clostridium difficile infection: Risk factors, treatment, and prevention. Gut Liver. 2019;13(1):16–24.
- Turner NA, Anderson DJ. Hospital Infection Control : Clostridioides difficile. Clin Colon Rectal Surg. 2020;33:98–108.
- Guh AY, Adkins SH, Li Q, Bulens SN, Farley MM, Smith Z, et al. Risk Factors for Community-Associated Clostridium difficile Infection in Adults: A Case-Control Study. Open Forum Infect Dis. 2017;4(4):1–8.
- Gerding DN, Sambol SP, Johnson S. Non-toxigenic clostridioides (formerly clostridium) difficile for prevention of C. difficile infection: From bench to bedside back to bench and back to bedside. Front Microbiol. 2018;9(JUL):1–13.
- de Bruyn G, Gordon DL, Steiner T, Tambyah P, Cosgrove C, Martens M, et al. Safety, immunogenicity, and efficacy of a Clostridioides difficile toxoid vaccine candidate: a phase 3 multicentre, observer-blind, randomised, controlled trial. Lancet Infect Dis. 2021;21(2):252–62.
