NOTA CIENTÍFICA:
HALLAZGO INCIDENTAL DE ADENOCARCINOMA MUCINOSO POR SOSPECHA DE MASA PERIANAL (INCIDENTAL FINDING OF MUCINOUS ADENOCARCINOMA FOR SUSPECTED PERIANAL MASS)
Aroa Abascal, Begoña Fadrique, Nicolás Monge, Javier Etreros, Juan Guillermo Aís.
Servicio de Cirugía General y del Aparato Digestivo, Hospital General-Complejo Asistencial de Segovia, Segovia, España.
Correspondencia: para contactar con el autor accionar aquí (Aroa Abascal).
Rev Acircal. 2021; 8 (2): 38-51.
Palabras clave: adenocarcinoma mucinoso perianal, resonancia magnética, fístula perianal.
Descargar artículo en PDF
Introducción:
Los tumores de la región perianal son poco frecuentes y pueden presentarse de diversas formas (1). Pueden imitar los síntomas y signos de la sepsis anorrectal por lo que son tumores que presentan dificultad para ser diagnosticados, ya que se caracterizan por un crecimiento lento hacia la fosa isquiorrectal y por la ausencia de tumor dentro de la luz rectal (2). Dentro de ellos se encuentra el adenocarcinoma mucinoso perianal que se supone que se origina en el epitelio mucosecretor de las glándulas anales. Su diagnóstico de certeza es histológico (3,4); la colonoscopia no es diagnóstica y de las pruebas de imagen (ECO, TAC y RMN) la RMN parece ser la más informativa. El tratamiento propuesto es la cirugía radical para control local de la neoplasia. El rol y el momento de la quimioterapia y/o radioterapia en estos tumores no está bien definido.
Caso clínico:
Paciente mujer de 49 años que comienza en julio de 2016 con una tumoración palpable y dolorosa en zona glútea derecha en el contexto de un leve traumatismo sin secreción anal. Como antecedentes de interés destacan una histerectomía y doble anexectomía en 2013 por estruma ovárico e infiltración del nervio pudendo derecho por dolor en sedestación en 2015 aparte de una colonoscopia normal.
Su médico de atención primaria le pauta antibióticos y antiinflamatorios sin mejoría. La masa fue aumentando de tamaño y fue remitida a Cirugía para estudio. Dos meses después, a la exploración física se evidencia una tumoración dolorosa, no móvil, palpable en región glútea derecha que se extiende hacia la región sacra de unos 3 cm sin signos de infección (eritema o fluctuación); por lo demás no presenta otras alteraciones y se encuentra afebril y hemodinámicamente estable.
La analítica no refleja datos de infección y se realiza una ecografía endorrectal donde se objetiva una tumoración heteroecoica pararrectal derecha que se extiende hasta la rama derecha del puborrectal de 3,5×2,5 cm (ver imagen 1). Se completa estudio con resonancia magnética donde se informa una formación de 13×7,5×6,5 cm hiperintensa en T2 e hipointensa en T1 de borde lobulado y bien definido, con múltiples septos en su interior, en región pararrectal derecha ocupando la fosa isquiorrectal, con aparente comunicación con la pared lateral derecha del recto a las 8 horas a la altura del esfínter anal sin poder descartar etiología neoplásica (ver imagen 2), ni orientar más su posible naturaleza.
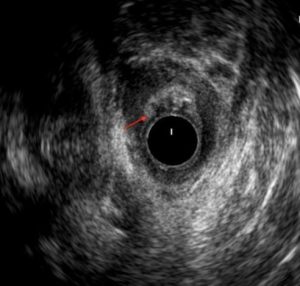
Imagen 1: Ecografía endorrectal: tumoración pararrectal derecha que se extiende hasta rama derecha del puborrectal de 3,5×2,5 cm.
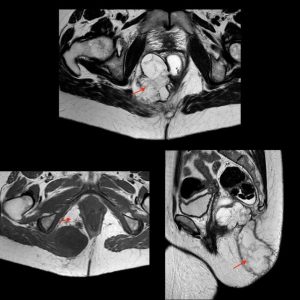
Imagen 2: Resonancia magnética: formación de 13×7,5×6,5 cm hiperintensa en T2 e hipointensa en T1 de borde lobulado y bien definido, con múltiples septos en su interior en región pararrectal derecha ocupando la fosa isquiorrectal, con aparente comunicación con la luz anorrectal.
Ante la sospecha de lesión neoplásica sospechosa de malignidad de la fosa isquiorrectal derecha, se decide biopsia escisional para caracterización histológica, con intención de resección completa de entrada.
Se realiza intervención quirúrgica el 7 de noviembre de 2016. Se sitúa a la paciente en posición de navaja. Mediante una incisión semicircular en la piel, paralela al margen anal incluyendo parte de la piel suprayacente, se accede a la fosa isquiorrectal derecha. Se evidencia tumoración quística con ausencia de plano de separación entre la cápsula y tejidos grasos y musculares adyacentes. Se realiza exéresis completa de tumoración, tejido graso (vaciamiento parcial de la fosa) y tejido muscular glúteo mayor derecho adyacente respetando el complejo esfinteriano y el elevador del ano. Se evidencia comunicación del tumor con pared lateral derecha de recto de menos de 5 mm que se cierra con puntos de Polysorb 2/0 comprobando la estanqueidad de la pared rectal. Cierre con Polysorb 2/0 y de piel con nylon 2/0.
La evolución postoperatoria fue satisfactoria sin ninguna incidencia durante su ingreso de 7 días.
Su diagnóstico anatomopatológico refleja un adenocarcinoma mucinoso con áreas necróticas que infiltran el tejido adiposo y muscular estriado circundante. Se observa marcada fibrosis reactiva e inflamación crónica inespecífica con bordes de resección libres (R0). El carcinoma no infiltra los fragmentos cutáneos aislados de la pieza. Genes reparadores de proteínas intactos, CD X-2: positivo; Ck-20: positivo; CK7: positivo, lo que es compatible con posible origen ovárico o con tumores derivados de epitelio transicional y sus remanentes embrionarios. Se decidió revisar la anatomía patológica de la intervención ginecológica, descartándose la presencia de tumor maligno relacionable en la pieza de la cirugía previa.
Ante este resultado histopatológico de malignidad epitelial, se realiza una colonoscopia postquirúrgica sin evidencia de lesiones en el resto del colon, recto o ano y una PET-TAC al mes siguiente de la cirugía para descartar otros focos y de cara a plantear posible adyuvancia. La PET TAC describe captación positiva en zona postquirúrgica con 2 focos hipermetabólicos compatibles con adenopatías de 2,1×2 cm en región retrocrural izquierda a nivel de D-10 (con un SUV máximo de 4,9) y presacra derecha de 1,3×0,8cm (con un SUV máximo de 3,41) que sugieren persistencia tumoral. Valorado en Comité́ de Tumores, se plantean las diferentes opciones (ampliar cirugía con una amputación vs adyuvancia) y se decide conjuntamente con la paciente, explicando riesgos y beneficios, optar por tratamiento de RDT (Radioterapia) sobre el lecho quirúrgico y quimioterapia sistémica. Entre otros objetivos se buscaba evitar un estoma definitivo en una mujer joven. Recibe radioterapia externa hasta alcanzar una dosis total de 50,4 Gy entre el 14 de febrero y el 06 de abril de 2017. Precisó interrupción del tratamiento por radiodermitis grado III. Durante la RDT, se suspendió tratamiento con Oxaliplatino que se reintrodujo tras su fin. Último ciclo de tratamiento en el mes de julio de 2017.
Tras 5 años en seguimiento, la paciente se encuentra asintomática con analítica rigurosamente normal y tomografía toraco-abdómino-pélvica y resonancia magnética pélvica sin datos de recidiva tumoral (ver imagen 3).
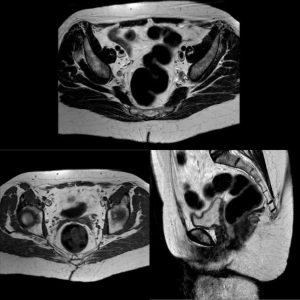
Imagen 3: Resonancia magnética pélvica a los 5 años tras tratamiento que no refleja datos de recidiva tumoral.
Discusión:
El carcinoma mucinoso de la región perianal es una entidad extremadamente rara, que representa sólo el 6,9% de las neoplasias anales y el 2-3% de todas las neoplasias gastrointestinales (1,5). Una revisión reciente de los adenocarcinomas mucinosos de todas las localizaciones, encontró que los tumores de la región anal son más frecuentes en los hombres (61,3 frente al 38,7%), con una edad media de 66,5 ± 14,8 años (6). En cuanto al área perianal, la localización más frecuente es la posterior (36-37%) seguido de la lateral (28-29%) y por último anterior (15-16%); y se asocia con fístulas en un 50% (7).
Las glándulas anales se presentan en número de seis a ocho en forma de pequeños túbulos con una a seis ramificaciones tubulares revestidas de epitelio columnar estratificado en la región perianal drenando a nivel de la línea dentada. La primera comunicación de que estas glándulas puedan originar un adenocarcinoma del conducto anal fue hecha por Rosser en 1934 (8). Su dificultad radica en conocer su verdadero origen, ya que es un tumor que crece en forma rápida a nivel local y produce destrucción temprana del lugar de origen. Actualmente se considera que son una transformación maligna del epitelio mucosecretor de la glándula perianal que penetra en la luz rectal a través de la línea dentada y crecen fundamentalmente hacia el tejido adiposo perianal, perirrectal y de la fosa isquiorrectal, confundiéndose en algunos casos con procesos benignos de la zona perianal (9,10,11).
El adenocarcinoma mucinoso se ha asociado típicamente con afecciones inflamatorias benignas como fístulas anales crónicas, abscesos perianales, tuberculosis, diabetes, sífilis, linfogranuloma venéreo o enfermedad de Crohn perianal. Su diagnóstico es tardío porque en ocasiones se confunde con los cuadros benignos subyacentes o precursores (10).
El tumor es de crecimiento lento, y generalmente bien diferenciado. Debido al curso indoloro y la histología inocua puede ser un problema diagnóstico para cirujanos y patólogos. Los síntomas más frecuentes son el sangrado perianal mínimo, dolor perianal o durante la defecación, presencia de una masa perianal, prurito anal, mucorrea (12) o la clínica de la fístula si estuviera asociada.
Las metástasis linfáticas se dan en ganglios pélvicos y preaórticos y son a través de los linfáticos del recto y de allí hacia la arteria mesentérica inferior. Las metástasis hemáticas son más tardías a través de las hemorroidales media e inferior, finalizando en los ganglios hipogástricos (13). De hecho, los ganglios inguinales son la localización metastásica más frecuente (21) siendo muy infrecuentes las metástasis distantes en órganos como hígado y pulmón.
Por el tipo de lesión puede ser diagnosticada en la histología de una hemorroidectomía o de una fistulectomía y por ello es importante enviar a patología todo el tejido resecado de la región anal en cualquier intervención. Dentro de los diagnósticos diferenciales, se deben incluir también enfermedades benignas como la dilatación quística de las glándulas anales, úlceras rectales solitarias, hiperplasia del trayecto fistuloso, enfermedad de Paget, colitis quística profunda, etc. (14). Para el diagnóstico es necesario tomar una biopsia profunda de la masa tumoral, la PAAF no suele ser diagnóstica. Sin embargo, existe el riesgo de diseminación del tumor, infección local e incluso de meningitis como muestra la serie de Jao SW et al. de la Mayo Clinic con 6 diseminaciones, 2 abscesos retrorrectales y 1 fístula fecal de 9 casos biopsiados (15). En aquellos casos en que se considere necesario realizar la biopsia, debe evitarse la transrectal dado que en caso de neoplasia maligna deberá extirparse el recto incidido y en caso de quiste implica un elevado riesgo de infección. Puede realizarse una biopsia transperineal o parasacra, dentro del área de resección planificada, asegurando la extirpación del trayecto de la aguja durante la cirugía definitiva. La biopsia también resulta útil en tumores irresecables para filiar la estirpe tumoral (16) y poder orientar el tratamiento paliativo con quimioterapia o radioterapia. Esto apoya la biopsia exerética realizada en nuestro caso, aunque no se sospechara claramente el adenocarcinoma mucinoso antes de su realización. El diagnóstico precoz es fundamental para el tratamiento, la combinación de terapia adyuvante pre y postoperatoria es la base para el tratamiento definitivo de este tumor.
La rectosigmoidoscopia aporta información sobre todo indirecta, ya que, aunque el tumor respeta la luz del recto y no generar masa luminal, puede comunicar con ella, podría observarse impronta tumoral y permite valorar potenciales lesiones sincrónicas asociadas que pueden modificar la decisión terapéutica. La ecografía transrrectal (17), TAC y la RMN son estudios complementarios que se indican para identificar la lesión y la estratificación preoperatoria para indicar un tratamiento apropiado. La resonancia magnética (RM), parece ser más precisa, mostrando líquido hiperintenso en imágenes ponderadas en T2, componentes sólidos realzados y una fístula entre la masa y el ano (18). La tomografía por emisión de positrones con FDG tiene un uso limitado para el diagnóstico, porque existe una correlación negativa entre la cantidad de mucina presente y la captación tumoral de fluorodesoxiglucosa (19).
El tratamiento ideal del adenocarcinoma mucinoso perianal es discutido. La resección local está indicada o se considera si el tamaño y la extensión del tumor hacia la fosa isquiorrectal es limitada en ausencia también de sospecha de afectación ganglionar. A pesar de que estos tumores pueden ser resecados en forma completa con esta técnica, manteniendo indemne la continencia anal, el seguimiento debe ser estricto por la posibilidad de recidiva local. La amputación abdominoperineal (AAP) es el procedimiento de elección si hay recidiva tumoral o en casos con mayor extensión y/o sospecha de afectación ganglionar adyacente a la lesión. En nuestro caso, la finalidad inicial de la cirugía era fundamentalmente diagnóstica, aunque se pudo hacer una resección local completa y satisfactoria oncológicamente una vez conocida la naturaleza de la lesión. En esta patología, es importante que el contenido completo de la fosa isquiorrectal y la piel por encima del tumor sean resecados (20,21).
Los pacientes con adenopatías inguinales al diagnóstico tienen peor pronóstico por el alto porcentaje de asociar otra enfermedad a distancia (25).
Comparando la resección local con la AAP, con ésta última se incluyen ganglios locorregionales (del mesorrecto y/o pélvicos) pero no está claro el impacto que esto pueda tener en los resultados. La literatura está orientándose hacia maximizar el control local de la enfermedad y disminuir el riesgo de metástasis con una QMT intensiva con/sin radioterapia asociada. De hecho, si hay adenopatías inguinales cada vez más estudios recomiendan la QRT combinada como mejor tratamiento, reservando la cirugía radical (AAP) como rescate. La presencia de una fístula con clínica no condiciona la decisión entre escisión local completa y AAP si se puede realizar una exéresis completa y reparación de la fístula.
El papel de la RDT en el tratamiento del adenocarcinoma mucinoso no está establecido, sin embargo, se ha descrito que un seguimiento estricto asociado a quimioterapia y/o radioterapia adyuvante puede prevenir la recidiva local y/o diagnosticarla precozmente (22).
Dado que las glándulas anales son histológica y embriológicamente diferentes al epitelio escamoso anal, el esquema de quimioterapia aconsejado no suele incluir mitomicina (protocolos cáncer de canal anal), utilizándose generalmente los regímenes clásicos del adenocarcinoma rectal basados en 5-fluoracilo, asociado o no a oxaliplatino (23,24,25).
Respecto a la RDT, la dosis debe ser diferente según la existencia o no de afectación inguinal y la modalidad terapéutica (23). Se aconseja utilizar dosis superiores a 54-55 Gy cuando se utiliza QRT inicial, mientras que, en los que solo se utilice RT, la dosis debe aumentarse a 60-66 Gy. En aquellos pacientes sin invasión inguinal conocida que reciban QRT asociada o no a cirugía, la dosis profiláctica aconsejada es de 45 Gy. Papagikos et al. (25), debido al mal pronóstico de los pacientes que se presentan con adenopatías inguinales, priorizan el uso de QRT inicial (con dosis superiores a 55 Gy) y QMT sistémica adicional, con resección quirúrgica utilizada selectivamente o para recurrencias locales aisladas.
Respecto a la modalidad de uso, hay literatura de uso de RDT y/o quimioterapia tanto de forma pre (neoadyuvante) como postoperatoria (adyuvancia) sin existir un claro consenso. El uso neoadyuvante se indicará mayoritariamente en lesiones avanzadas, con adenopatías locales (pélvicas, etc.) y/o a distancia (inguinales, en este caso puede ser el único tratamiento).
El adenocarcinoma anal mucinoso presenta una historia natural más agresiva que el carcinoma escamoso, con menor supervivencia y mayores tasas de recurrencia, tanto local como a distancia. Aunque se han descrito buenos resultados en pacientes con neoplasias que se detectan en fases precoces, la similitud clínica con otras enfermedades benignas y la menor expresión del componente tumoral en la mucosa suelen ser razones que retrasan el diagnóstico y, por tanto, empobrecen el pronóstico (26). En general los pacientes con ADC mucinoso del canal anal se presentan en mayor porcentaje con enfermedad avanzada, metástasis a distancia y, consecuentemente, tendrán menor supervivencia global.
Conclusiones:
El adenocarcinoma mucinoso perianal es poco frecuente y puede presentarse como tumor primario o secundario a procesos cronificados como fístulas anales.
Generalmente es de crecimiento lento, curso indoloro y poco agresivo por lo que puede ser un problema diagnóstico para cirujanos y patólogos. El diagnóstico precoz es fundamental para el tratamiento, siendo la combinación de terapia adyuvante pre y postoperatoria y la cirugía la base para el tratamiento definitivo de este tumor.
En algunos casos se puede realizar una resección local del tumor, incluso en tumores aparentemente voluminosos como nuestro caso. Sostenemos que este tipo de cirugía tiene que ser estrictamente seguido con controles durante años, como en nuestra paciente, para detectar una recidiva local, y si existe la sospecha de extensión tumoral local la indicación quirúrgica es la amputación abdominoperineal.
Declaraciones y conflicto de intereses: Los autores han revisado y dado su autorización para la publicación del artículo. Asimismo, declaran no tener ningún conflicto de intereses, no haber presentado el trabajo en reunión y/o congreso alguno, y que no está siendo evaluado por otra publicación científica de forma simultánea.
Referencias bibliográficas:
- V.D. Pai, S. Jatal, R. Engineer, V. Ostwal, A.P. Saklani. Multidisciplinary management of colorectal adenocarcinoma associated with anal fistula: an Indian series, Colorectal Dis. 17 (11) (2015): 240–246.
- Baars JE, Kuipers EJ, Dijkstra G, Hommes DW, de Jong DJ, Stokkers PC. Malignant transformation of perianal and enterocutaneous fistulas is rare: results of 17 years of follow-up from the Netherlands. Scand J Gastroenterol 2011; 46: 319–25.
- Díaz-Vico T, Fernández-Martínez D, García-Gutiérrez C, Suárez-Sánchez A, Cifrián-Canales I, Mendoza-Pacas GE, et al. Mucinous adenocarcinoma arising from chronic perianal fistula—A multidisciplinary approach. J Gastrointest Oncol 2019; 10: 589–96.
- Hisham RB, Rahman SA, Gul YA. Mucinous adenocarcinoma arising from chronic perianal fistula. Surg Pract 2007; 11:88–9.
- S.L. Jee, H. Amin-Tai, N.Q. Fathi, M.F. Jabar, Perianal mucinous adenocarcinoma diagnosed by histological study of anorectal abscess with fistula, Case Rep. J. 5 (2018) e21.
- M.G.K. Benesch, A. Mathieson, Epidemiology of mucinous adenocarcinomas. Cancers (Basel) 12 (11) (2020) 3193.
- Jorge A Hequera, Guillermo Obregón, Laura Banchero, Sergio Arece. Adenocarcinoma mucinoso primario de glánduas anales. Revista Mexicana de Coloproctología, Vol. 13, No. 2, Mayo-Agosto 2007.
- C. Rosser. The relation of fistula-in-ano to cancer of the anal canal. Trans. Am.Proc. Soc. 35 (1934): 65–71.
- K.-I. Okada, T. Shatari, T. Sasaki, T. Tamada, T. Suwa, T. Furuuchi, Y. Takenaka, M. Hori, M. Takuma. Is histopathological evidence really essential for making a surgical decision about mucinous carcinoma arising in a perianal fistula? Report of a case. Surg. Today 38 (2008) 555–558.
- Alvarez-Laso CJ, Moral S, Rodríguez D, Carrocera A, Azcano E, Cabrera A, et al. Mucinous adenocarcinoma on perianal fistula. A rising entity? Clin Transl Oncol 2017; 20:666–9.
- Refael Itah, Nachum Werbin, Yehuda Skornick, Ron Greenberg. Anal mucinous adenocarcinoma arising in long standing fistula in ano. Harefuah. 2008 Feb;147(2):117-9, 183.
- Hongo K, Kazama S, Sunami E, Kitayama J, Watanabe. Perianal adenocarcinoma associated with anal fistula: a report of 11 cases in a single institution focusing on treatment and literature review. Hepatogastroenterology. 2013 Jun; 60 (124): 720-6.
- Anthony T, Simmang C, Lee EL et al. Perianal mucinous adenocarcinoma. J Surg Oncol 1997; 64: 218-21.
- Ong J, Jit-Fong L, Ming-Hian K, Boon-Swee O, Kok-Sun H, Eu KW. Perianal mucinous adenocarcinoma arising from chronic anorectal fistulae: a review from a single institution. Tech Coloproctol. 2007; 11:34–8.
- Jao SW, Bear RW Jr, Spencer RJ, Reimans HM, Ilstrup DM. Retrorectal tumors. Mayo Clinic Experience, 1960-1979. Dis Colon Rectum 1985; 28: 644-52.
- Prasad AR, Amin MB, Randolph TL, Lee CS, Ma CK. Retrorectal cystic hamartoma: report of 5 cases with malignancy arising in 2. Arch Pathol Lab Med. 2000; 124: 725-9.
- T. Toyonaga, R. Mibu, H. Matsuda, Y. Tominaga, K. Hirata, M. Takeyoshi, M.Tsuneyoshi, M. Matsushima, Endoanal ultrasonography of mucinous adenocarcinoma arising from chronic fistula-in-ano: three case reports. J.Anus Rectum Colon 1 (3) (2017): 100–105.
- T. Yamaguchi, R. Kagawa, H. Takahashi, R. Takeda, S. Sakata, D. Nishizaki. Diagnostic implications of MR imaging for mucinous adenocarcinoma arising from fistula in ano, Tech. Coloproctol. 13 (3) (2009) 251–253.
- A.M. Wnorowski, C.O. Menias, P.J. Pickhardt, D.H. Kim, A.K. Hara, M.G. Lubner. Mucin-containing rectal carcinomas: overview of unique clinical and imaging features, Am. J. Roentgenol. 2013 (2019): 1–9.
- Schaffzin DM, Stahl TJ, Smith LE. Perianal mucinous adenocarcinoma: unusual case presentations and review of the literature. Am Surg, 69 (2003), pp. 166-9
- Claudio F. Feo, Simone Veneroni, Antonio Santoru, Maria Laura Cossu, Antonio M. Scanu,Giorgio C. Ginesu∗, Alberto Porcu. Perianal mucinous adenocarcinoma with dysplastic polyps of the colon: A case report. International Journal of Surgery Case Reports 78 (2021) 99–102.
- Wolfgang B Gaertner, Gonzalo F Hagerman, Charles O Finne, Karim Alavi, Jose Jessurun, David A Rothenberger, Robert D Madoff. Fistula-associated anal adenocarcinoma: good results with aggressive therapy. Dis Colon Rectum 2008 Jul; 51 (7):1061-7.
- Chang GJ, Gonzalez RJ, Skibber JM, Eng C, Das P, Rodriguez- Bigas MA. A twenty-year experience with adenocarcinoma of the anal canal. Dis Colon Rectum. 2009; 52: 1375–80.
- Warsch S, Bayraktar UD, Wen BC, Zeitouni J, Marchetti F, Rocha-Lima CM, et al. Successful treatment of anal gland adenocarcinoma with combined modality therapy. Gastrointest Cancer Res. 2012 Mar; 5 (2): 64-6.
- Papagikos M, Crane CH, Skibber J, Janjan NA, Feig B, Rodriguez-Bigas MA, et al. Chemoradiation for adenocarcinoma of the anus. Int J Radiat Oncol Biol Phys. 2003; 55: 669–78.
- Meriden Z, Montgomery E. Anal duct carcinoma: a report of 5 cases. Hum Pathol. 2012; 43: 216–20.
