NOTA CIENTÍFICA:
MALACOPLAQUIA GÁSTRICA COMO CAUSA DE HEMORRAGIA DIGESTIVA ALTA GRAVE.
Diego Lapiedra1, Álvaro Castro1, Rosana Fernández2, Fernando González3, Marcelo Viola4.
1-Profesor Adjunto Clínica Quirúrgica 1. 2-Servicio de Anatomía Patológica. 3-Profesor Clínica Quirúrgica 1. 4-Profesor Agregado Clínica Quirúrgica 1. Hospital Pasteur, Montevideo, Uruguay.
Correspondencia: para contactar con el autor accionar aquí (Diego Lapiedra).
Rev Acircal. 2019; 6 (2): 91-104.
Palabras clave: Malacoplaquia, Hemorragia, Gastrectomía, Michaelis-Gutmann.
Descargar artículo en PDF
Introducción:
La malacoplaquia es una rara enfermedad granulomatosa crónica, caracterizada por la presencia de tumoraciones de apariencia neoplásica y agresividad variable desde el punto de vista local, más comunes a nivel del aparato urinario, fundamentalmente en la vejiga, pero que también puede dañar al resto del aparato urinario, al tracto gastrointestinal, a la piel, los pulmones, los huesos y los ganglios linfáticos mesentéricos. Desde el punto de vista histológico se caracteriza por presentar células inflamatorias (monocitos y macrófagos) formando grandes agregados de histiocitos conocidos como células de Von Hansemann, con acúmulos intracitoplasmáticos denominados cuerpos de Michaelis-Gutmann que también están presentes a nivel extracelular. Desde el punto de vista macroscópico se caracteriza por la presencia de unas placas blandas que dan el nombre a la enfermedad (placos significa placas, y malacos blandas).
El compromiso del tracto gastrointestinal por esta enfermedad es extremadamente infrecuente, existiendo contados casos publicados de malacoplaquia gástrica exclusiva.
Presentamos el caso de un paciente que cursó con una hemorragia digestiva alta con grave repercusión hemodinámica, que requirió una gastrectomía total de urgencia por sangrado incoercible. El informe anatomopatológico evidenció una malacoplaquia gástrica sin encontrar elementos sugestivos de malignidad.
Si bien es una patología que rara vez afecta el aparato digestivo, la malacoplaquia debe ser tenida en cuenta como diagnóstico diferencial en las lesiones que simulan neoplasias.
La suspensión de agentes potencialmente etiológicos como la inmunosupresión, el uso prolongado de antibióticos y drogas agonistas colinérgicas y la administración de vitamina C parecen ser efectivos en el tratamiento, quedando la cirugía relegada a las complicaciones o dudas diagnósticas.
Aunque la malacoplaquia no es una enfermedad neoplásica ni maligna, su agresividad local, así como la posibilidad de extensión a distancia (como se observará en este caso) pueden generar graves repercusiones funcionales que lleven a la muerte del paciente.
Caso clínico:
Varón de 63 años, ex fumador intenso (IPA 42 con cese del hábito tabáquico 1 año antes del episodio) y que se reconoce como “estresado” de forma crónica.
Refiere historia de un año de evolución de plenitud precoz, sensación de repugnancia no selectiva por los alimentos, anorexia, astenia y adelgazamiento de 10kg. Quince días previos a la consulta comienza con dolor en epigastrio intenso, punzante e irradiado al dorso y pirosis, que aparece de forma inmediata a la ingesta de alimentos.
El día del ingreso presenta hemorragia digestiva alta con repercusión hemodinámica y anemia clínica, con hemoglobina de 8.7 g/dl y hematocrito de 25.6%. Se le repone con infusión intravenosa de cristaloides y un concentrado de glóbulos rojos, estabilizándose el paciente y solicitándose fibrogastroscopía de urgencia que evidencia lesión ulcerada subcardial de bordes irregulares, cubierta por coágulos y material necrótico (ver imagen 1).
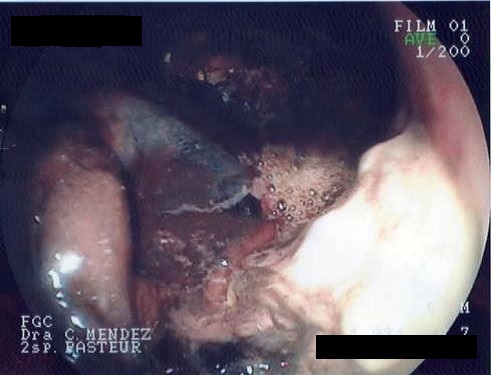
Imagen 1: Fotografía de la primera endoscopía en la que se observa la lesión gástrica de aspecto neoplásico.
El paciente tiene una evolución inicial satisfactoria bajo tratamiento médico con inhibidores de la bomba de protones y antiácidos, sin recidiva del sangrado. Ante la posibilidad de estar frente a un cáncer gástrico por las características de la lesión en la endoscopía, se solicita una tomografía tóraco-abdominal que muestra pequeños nódulos pulmonares bilaterales y una extensa masa centroabdominal heterogénea y de centro hipodenso, en relación con la curvatura menor gástrica. Además el hígado presenta dos lesiones sólidas menores a 10mm en segmentos VI y VII, hay lesiones hipodensas múltiples en bazo de aspecto secundario y se observan gruesas adenomegalias retroperitoneales periaórticas e intercavoaórticas (ver imagen 2).
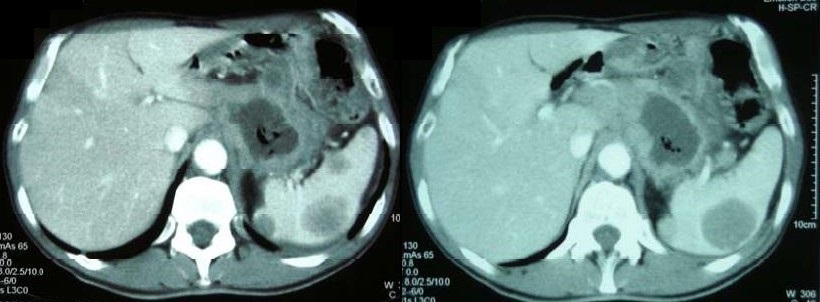
Imagen 2: Imágenes de la tomografía computerizada en la que se observa el extenso proceso que infiltra la curvatura menor gástrica y se extiende al retroperitoneo, así como las imágenes nodulares hipodensas esplénicas.
Se realiza toma de biopsias de la lesión gástrica por nueva endoscopía, no mostrando la anatomía patológica elementos de malignidad, ni aportando un diagnóstico concreto, refiriendo únicamente el hallazgo de “cambios inflamatorios inespecíficos”.
Estando en espera de nuevo estudio endoscópico y biopsia que confirmara el planteamiento diagnóstico, el paciente presenta un episodio de hematemesis con grave repercusión hemodinámica, incoercible mediante endoscopía, por lo que se decide cirugía de emergencia.
En la exploración quirúrgica destaca una masa pétrea polilobulada que involucra la curvatura menor gástrica, infiltra la cabeza del páncreas y el retroperitoneo, con múltiples adenomegalias retroperitoneales. Se realiza gastrectomía total de necesidad, con esófago-yeyunostomía en Y de Roux.
El paciente tiene una buena evolución postoperatoria, siendo dado de alta a los 10 días de la intervención, sin presentar complicaciones relevantes.
El informe anatomopatológico de la pieza de resección destaca: extenso proceso inflamatorio crónico, formado por conglomerados de macrófagos con el aspecto de histiocitos de Von Hansemann, con inclusiones citoplasmáticas correspondientes a cuerpos de Michaelis-Gutmann (ver imágenes 3 y 4).
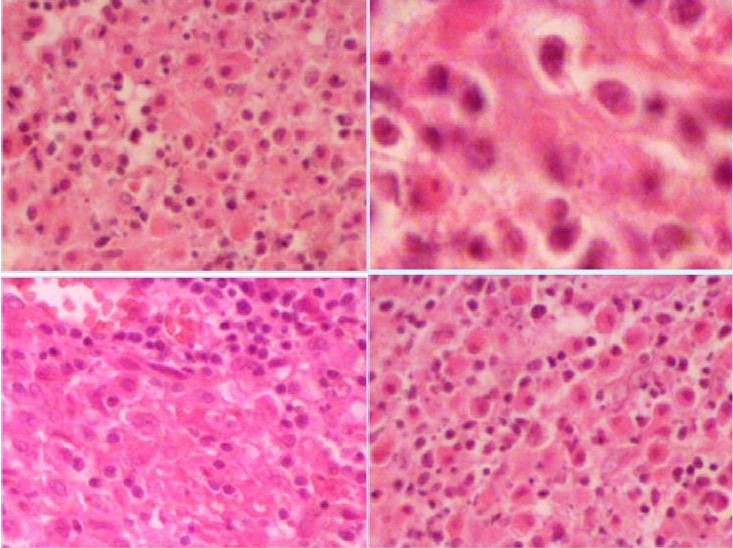
Imagen 3: Imágenes de la microscopía en la que se observan las células de Von Hansenmann y los cuerpos de Michaelis-Gutmann.
Ante el resultado histológico, se decide ampliar el estudio del paciente, en búsqueda de lesiones asociadas y potenciales causas. Para descartar lesiones similares a nivel de la mucosa intestinal, así como colopatías generadoras de inmunodepresión (Colitis Ulcerosa o Crohn) se realiza fibrocolonoscopía que no objetiva lesiones mucosas. Se solicitó consulta con el equipo de urología, realizándose una cistoscopía en busca de una malacoplaquia por su frecuencia en dicha localización, no observándose lesiones a dicho nivel. Se considera por todo ello que la enfermedad sería primariamente gástrica, pudiendo corresponder las imágenes hepáticas y pulmonares a una diseminación sistémica de la enfermedad, o bien a una asociación lesional con otra patología. El caso es discutido en sesión multidisciplinar y se decide en principio no realizar biopsia de dichas lesiones hepato-pulmonares.
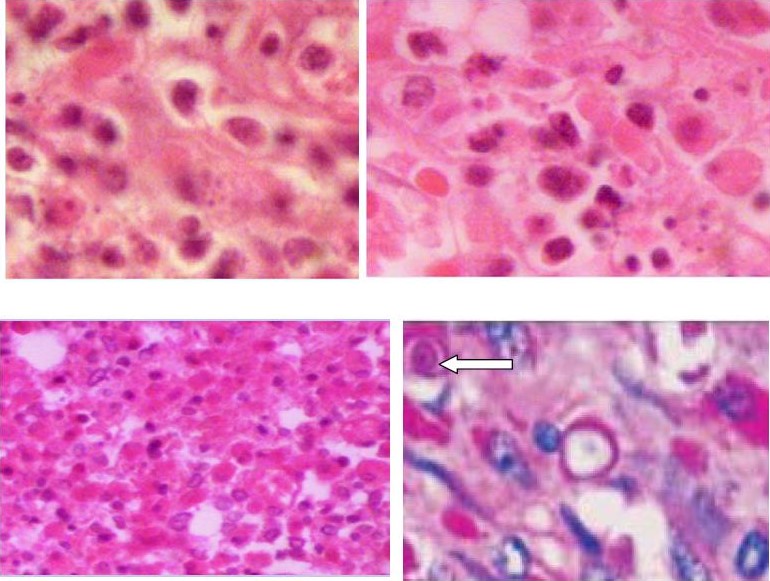
Imagen 4: Células de Von Hansenmann y cuerpos de Michaelis-Gutmann observados en la microscopía óptica.
Se realizó la búsqueda de enfermedades generadoras de inmuno-supresión, descartándose VIH, VHB y VHC, otros cánceres (digestivos, urinarios y pulmonares), hemopatías, lupus y otras enfermedades autoinmunes, el uso crónico de medicación inmunosupresora, así como trastornos nutricionales previos (IMC 22.9 al ingreso). Por ello el origen en este caso puede considerarse idiopático.
Se mantiene bajo tratamiento antibiótico con ciprofloxacina y con vitamina C, con un seguimiento irregular en policlínica, a la que asiste en contadas revisiones, presentando un descenso ponderal progresivo importante, llegando a un IMC de 14.8. Reingresa a los 6 meses debido a una desnutrición proteico-calórica severa, con deposiciones líquidas abundantes, y un derrame pleural bilateral, que determina una importante insuficiencia respiratoria. Presenta además el hallazgo clínico y tomográfico de adenopatías en ambas regiones supraclaviculares de aspecto neoplásico, sin cambios en cuanto a los hallazgos hepáticos y pulmonares respecto a la tomografía previa. La biopsia de dichas adenopatías observa células de Von Hasenmann y cuerpos de Michaelis-Gutmann. El líquido de derrame pleural resulta ser un trasudado, con células inflamatorias en el estudio citológico. A pesar de todas las medidas el paciente mantiene un mal estado general y una evolución similar al paciente oncológico evolucionado, con un gran deterioro del estado nutricional que no se logra mejorar. Fallece por insuficiencia respiratoria en el contexto de una neumonía intrahospitalaria a los 8 meses de la cirugía.
Discusión:
La malacoplaquia es una enfermedad granulomatosa crónica extremadamente infrecuente, descripta por primera vez por el profesor Von Hansemann en Alemania en 1901, siendo éste quien otorga el nombre a la enfermedad (del griego “malakos” blando, y “plakos” placa) (1-5).
Afecta al aparato genitourinario en hasta el 80% de los casos, siendo su sitio de presentación más frecuente la vejiga, existiendo, aunque menos frecuentemente, casos reportados a nivel del riñón, los uréteres y la pelvis renal, así como en la próstata y a nivel uretral (2.5-7).
El aparato gastrointestinal ocupa el segundo lugar en frecuencia, predominando la localización de la enfermedad en el colon descendente, colon sigmoide y recto. También se afectan, aunque en menor proporción el íleon terminal, el apéndice y el ciego (2,8-9). El compromiso gástrico en esta patología es extremadamente infrecuente, existiendo pocos casos documentados (2,10-16), siendo más infrecuente aún el compromiso exclusivo gástrico (15). Es excepcional la presentación diseminada con una evolución seudo-neoplásica (17), como se ha presentado la enfermedad en nuestro paciente.
Otros sitios que pueden verse afectados son el cerebro, la piel, la lengua, el globo ocular, la glándula tiroides, glándulas suprarrenales, la parótida, ganglios linfáticos, los pulmones, el páncreas y hueso (4,18-24).
Se presenta más comúnmente en el sexo femenino, sobre todo en mayores de 50 años (aunque hay escasos casos presentados en niños como en el artículo de Jadhay y Patil (9)), y en general en pacientes inmunodeprimidos, ya sea aquellos que recibieron poliquimioterapia, portadores de VIH-SIDA, lupus eritematoso sistémico, enfermedad celíaca, colitis ulcerosa o trasplantados (3,4,18). Existen sin embargo casos de malakoplakia en pacientes sin antecedentes de inmunodepresión, como el presentado por Kyung en 2013 (25). El diagnóstico de la enfermedad es eminentemente histológico.
La etiología es desconocida, pero se asocia a infección urinaria por Escherichia coli en el 95% de los casos y a síndromes de inmunodeficiencia, enfermedades autoinmunes o carcinomas en el 40%. La asociación entre malacoplaquia y cáncer ha sido comprobada en múltiples casos, existiendo trabajos que encuentran adenocarcinomas colorrectales hasta en un 30% de pacientes con malacoplaquia del tracto gastrointestinal (2,5).
De mecanismo poco claro, aparentemente existiría una pobre actividad bactericida de los monocitos-macrófagos, quienes serían capaces de fagocitar pero no de digerir los microorganismos intralisosomales. Estudios de biología molecular en los macrófagos de estos pacientes han demostrado un déficit de Guanosin Monofosfato Cíclico (GMPc), quien a su vez participa en la síntesis del factor de necrosis tumoral, clave en la función bactericida celular. Por tanto existirían factores inherentes al propio paciente que lo harían susceptible de padecer la enfermedad. Al mismo tiempo, estos enfermos tienen la particularidad de haber cursado o encontrarse cursando infecciones crónicas y/o recidivantes a gérmenes muy variados, entre los que predomina hasta en un 80-95% Escherichia coli. Se han encontrado también a nivel intralisosomal, gérmenes como Proteus, Klebsiella, Shigella, Paracoccidioides br., Rodococcus equi, Pseudomona, Enterobacter, Staphylococcus aureus y hongos entre otros (1,2,4). Así, la teoría más aceptada es que existiría un defecto en la respuesta de los lisosomas de los macrófagos frente a una infección bacteriana crónica, con acumulación de los microorganismos no digeridos a nivel intracelular y formación de masas inflamatorias de crecimiento progresivo (1).
En el órgano afectado se puede observar macroscópicamente la infiltración de la pared por un tejido friable, amarillento-anaranjado, originado en la submucosa que pude configurar una o más lesiones.
Microscópicamente estas masas se componen de acúmulos de células inflamatorias (histiocitos y macrófagos) poligonales, con citoplasma eosinófilo, que se acumulan en la muscularis propia y reciben el nombre de células o cuerpos de Von Hansemann. Estos contienen inclusiones citoplasmáticas características calcificadas, PAS positivas denominadas cuerpos de Michaelis-Gutmann. La presencia de estas células con sus típicas inclusiones en un tejido, es patognomónico de la malacoplaquia (1-4,18-20). La observación celular mediante microscopía electrónica ha demostrado que la matriz de los cuerpos de Michaelis-Gutmann está compuesta por microorganismos intracelulares no digeridos (3).
La presentación clínica dependerá del órgano afectado por la enfermedad, no existiendo así un cuadro característico (4). Muchas veces el proceso simula otras enfermedades más frecuentes, fundamentalmente cánceres. De la misma forma no existen estudios paraclínicos que puedan hacer el diagnóstico, salvo la biopsia lesional en la que se identifiquen los mencionados cuerpos de Michaelis-Gutmann.
La Tomografía Computarizada de abdomen puede mostrar la presencia de un proceso infiltrante de aspecto neoplásico, con zonas hipodensas por necrosis o abscesificación, y conglomerados ganglionares retroperitoneales, como ocurrió en el paciente que estamos presentando, llevando al diagnóstico erróneo de probable cáncer. Esto se debe al comportamiento agresivo en lo local que la enfermedad puede adoptar en algunos pacientes, sobre todo inmunodeprimidos, infiltrando las paredes del órgano y tejidos adyacentes (1,4,5).
La endoscopía puede ser de utilidad en el diagnóstico ya que permite valorar la lesión macroscópica y tomar muestras. La lesión típica es nodular o plana, de 1 a 2cm, con una depresión central. Existen 3 patrones endoscópicos de malacoplaquia: lesiones mucosas unifocales, lesiones multinodulares o polipoideas difusas y grandes masas lesionales que ocupan amplios sectores de la mucosa (2).
El tratamiento de la enfermedad se compone de varios pilares fundamentales; en primer lugar, si el paciente se encuentra bajo tratamiento inmunosupresor el mismo debe ser suspendido de inmediato. En segundo lugar, debe realizarse un tratamiento antibiótico prolongado, para lo cual las fluoroquinolonas han demostrado ser las más efectivas por su alta penetrancia a través de la membrana celular. La utilización de ciprofloxacina 500mg cada 12 horas por al menos 6 meses ha logrado remisión completa de la enfermedad en varios casos. Se ha citado también el uso de rifampicina, trimetroprim-sulfametoxasol y gentamicina con buenos resultados (1,3,4). Como complemento al tratamiento antibiótico y a fin de reforzar la función de los fagocitos puede utilizarse vitamina C, ya que la misma aumentaría los niveles de AMPc y GMPc y favorecería la síntesis del colágeno y la reparación tisular. De la misma forma, el betanecol (agonista colinérgico) elevaría los niveles intracelulares de GMPc, potenciando la acción bactericida de los macrófagos (3,5). El tratamiento quirúrgico no es la primera elección, estando reservado para casos en que falla el tratamiento médico, o frente a complicaciones como las presentadas por nuestro paciente (1,3,5).
La enfermedad puede recidivar, sobre todo si la inmunosupresión se mantiene, por lo que se debe controlar periódicamente al paciente.
A pesar de lo expuesto y lo que indica la bibliografía consultada, en nuestro paciente no se encontró una causa de inmunosupresión que favoreciera la aparición de la malacoplaquia, así como tampoco la asociación con cánceres del aparato digestivo, urinario o pulmonar. Esta ausencia de una causa que explique la enfermedad, la presentación predominantemente gástrica, y su evolución fulminante pseudo-neoplásica, con la aparición en la evolución de adenopatías supraclaviculares de aspecto metastásico (que fueron confirmadas por biopsia como debidas a la misma enfermedad) lo transforman en un caso muy particular y por ello lo reportamos. También hay publicados casos con afectación digestiva de curso mucho más indolente.
Conclusiones:
La malacoplaquia, aunque infrecuentemente, puede presentarse en forma de lesiones loco-regionalmente agresivas con carácter infiltrante, pudiendo asociar una diseminación visceral y ganglionar a distancia, como las neoplasias malignas.
La localización más frecuente es la urinaria, pero también está descrita la gástrica, por lo que debe ser tenida en cuenta como diagnóstico diferencial ante lesiones en las que no se logre un diagnóstico histológico, sobre todo en inmunodeprimidos.
La presentación como una hemorragia digestiva alta grave y como enfermedad diseminada simulando un cáncer, define el interés de nuestro caso. De la misma forma es llamativa la ausencia de una causa clara, situación descrita pero excepcional.
Declaraciones y conflicto de intereses: Los autores han participado en el manejo del paciente así como en la concepción del manuscrito y la redacción del texto. No hay conflictos de interés con la Revista Electrónica ACIRCAL.
Referencias bibliográficas:
- Torralba J, Lirón R, Morales G. Malacoplaquia polipoide de colon. Cir Esp 2002; 71(4): 213-5.
- Gustavo LC, Robert ME, Lamps LW. Isolated gastric malakoplakia: a case report and review of the literature. Arch Pathol Lab Med. 2004; 128(11): 153-6.
- Alvarez Gómez G, Marín Botero M, Henao Calle C. Malacoplakia: Case report in tongue and review of the literature. Med Oral Patol Oral Cir Bucal. 2008; 13(6): E352-4.
- Velásquez López JG, Vélez Hoyos A, Uribe Arcila JF. Malacoplaquia en urología: aportación de seis casos y revisión de la literatura. Actas Urol Esp 2006; 30(6): 610-618.
- Velásquez J, Velez A, Uribe J. Malacoplaquia en urología. Reporte de una serie de casos en un hospital universitario de Medellín, Colombia. Urología Colombiana 2006: 49-57.
- Zhang HX, Ma LL, Yang SM. Malakoplakia of the prostate: A case report. Beijing Da Xue Xue Bao Yi Xue Ban. 2011;18. 43(4): 620-2.
- Görgel SN, Balsi U, Sari AA. Malakoplakia of the prostate diagnosed by elevated PSA level and transrectal prostate biopsy. Kaohsiung J Med Sci. 2011; 27(4): 163-5.
- Kallel L, Daghfous A, Chelly I. Un cas de Malakoplakie mimant un cancer colique. La Tunise Medicale 2017; 95(3): 222-223.
- Jadhav MN, Patil RK, Kittur SK. Colorectal Malacoplakia in a child presenting as multiple polyposis coli. J Pathol Microbiol 2015;58: 86-88.
- Nakabayashi H, Ito T, Izutsu K. Malakoplakia of the stomach. Report of a case and review of the literature. Arch Pathol Lab Med. 1978; 102(3): 136-9.
- Boixeda D, Hernandez Ranz F, Moreira V. Malakoplakia gastrointestinal: revisión a propósito de un caso. Rev Clin Esp. 1978;148:415.
- Scheiner C, Dor AM, Basbous D. La malacoplaise: formes anatomocliniques, revue de la litte´rature, a` propos de 15 observations personelles. Arch Anat Pathol. 1975; 23: 199–208.
- Yunis EJ, Estevez JM, Pinzon GJ. Malacoplakia: discussion of pathogenesis and report of three cases including one of fatal gastric and colonic involvement. Arch Pathol. 1967; 83: 180–187.
- Ding X, Oliff A, Harpaz N. Gastric Malakoplakia. Gastrointest Endoscopy 2014. 80 (5): 903-904.
- Gustavo LC, Robert ME, Lamps LW. Isolated gastric Malakoplakia: A case report and review of the literature. Arch Patol Lab Med 2004. 128; (11): 153-6.
- Jin Bae K, Dong Soo H, Hang Lak L. Malakoplakia of the stomach. Gastrointest Endoscopy 2003. 58; (6): 441-445.
- Ventura V, Curbelo L , Puppo D , Perendones M , Dufrechou C. Malacoplaquia diseminada: evolución excepcional de una rara patología. Rev Med Urug 2011; 27: 38-41.
- Kianifar H, Sharifi N, Talebi S. Malakoplakia of colon in a child with celiac disease and chronic granulomatous disease. Indian J Gastroenterol. 2006; 25(3): 163-4.
- Karasavvidou F, Potamianos SP, Barbanis S. Malakoplakia of the colon associated with colonic adenocarcinoma diagnosed in colonic biopsies. World J Gastroenterol. 2007; 13(45): 6109-11.
- Kiliçgün A, Turna A, Gürses A. Pulmonary malacoplakia. Acta Chir Belg. 2006; 106(6): 732-3.
- Coates M, Martinez Del Piero M, Nassif R. A case of cutaneous Malakoplakia in the head and neck region and review of the literature. Head and Neck Patology 2016. 10; (4): 444-450.
- Tulpule M, Bharatia P, Pradhan A. Cutaneous Malakoplakia: Interesting case report and review of the literature. Indian J Dermatol Venereol Leprol 2017; 83: 584-6.
- Samian C, Ghaffar S, Nandapalan V. Malakoplakia of the parotid gland: a case report and review of localized malakoplakia of the head and neck. Ann R Coll Surg Engl 2019; 101 (5): 309-312.
- Köskal D, Özcan A, Demirag F. Pulmonary Malakoplakia: A case report and review of the literature. Tuberk Toraks 2014;62 (3): 248-252.
- Kyung H, Hyun Deok S, Dong Hoon K. Malakoplakia in a healthy young female patient. Korean J Intern Med 2013; 28(4):475-480.
