ARTÍCULO ORIGINAL:
¿CUÁNTO MÚSCULO ES SUFICIENTE? EL PSOAS COMO CENTINELA EN CIRUGÍA ONCOLÓGICA GÁSTRICA?
Manuel José Torres-Jurado (1), Felipe Carlos Parreño-Manchado (1), María Alejandra Arévalo González (2), Laura Vicente-González (3), Juan Sebastián Vargas-Parra (1), Francisco Javier García-Criado (2), Francisco Blanco-Antona (1), Omar Abdel-Lah Fernández (1)
1.- Departamento de Cirugía General y Digestiva, Hospital Universitario de Salamanca, Salamanca, España; 2.- Servicio de Radiodiagnóstico, Hospital Universitario de Salamanca, Salamanca, España 3.- Universidad de Salamanca, Salamanca, España
Rev Acircal. 2025; 11 (2): 18-26.
Palabras clave: Sarcopenia, Cáncer gástrico, índice del psoas, tomografía computarizada, supervivencia, cirugía oncológica, evaluación preoperatoria
Descargar artículo en PDF
Introducción
El cáncer gástrico es la tercera causa de muerte por cáncer a nivel mundial [1]. Pese a los avances en diagnóstico y tratamiento, la supervivencia sigue siendo limitada, especialmente en pacientes diagnosticados en estadios avanzados [2].
La sarcopenia, definida como la pérdida progresiva de masa y fuerza muscular, ha demostrado influir negativamente en el pronóstico de pacientes oncológicos [3,4]. En pacientes con neoplasias digestivas, se ha asociado a mayor tasa de complicaciones postoperatorias, menor respuesta al tratamiento adyuvante y disminución de la supervivencia [5,6].
El índice del área total del músculo psoas (TPAI), obtenido a partir de tomografía computarizada (TC), es una herramienta objetiva, accesible y reproducible para evaluar la masa muscular esquelética, especialmente en estudios retrospectivos [7,8]. Su uso ha mostrado valor pronóstico en diferentes tipos de cáncer, incluyendo colorrectal, hepatobiliar y gástrico [9–11].
Este estudio tiene como objetivo evaluar la relación entre TPAI, complicaciones postoperatorias y supervivencia en pacientes con cáncer gástrico sometidos a cirugía con intención curativa.
Materiales y métodos
Se realizó un estudio retrospectivo observacional en el Hospital Universitario de Salamanca. Se incluyeron pacientes con diagnóstico histológico de adenocarcinoma gástrico operados entre enero de 2020 y octubre de 2023.
- Criterios de inclusión:
• Diagnóstico confirmado de adenocarcinoma gástrico.
• Cirugía con intención curativa.
• Tomografía computarizada preoperatoria disponible.
• Seguimiento clínico superior a 12 meses o hasta fallecimiento. - Criterios de exclusión • Enfermedad metastásica al diagnóstico.
• Cirugías paliativas o de urgencia.
• Antecedente de cirugía gástrica previa por cáncer. - Evaluación muscular
El área del músculo psoas bilateral se midió a nivel del tercer cuerpo vertebral lumbar (L3) en cortes axiales de TC, como se ha descrito previamente [8,9]. El TPAI se calculó dividiendo el área total del psoas (cm²) entre la talla al cuadrado (m²). Se definió sarcopenia con puntos de corte de TPAI <5.90 cm²/m² para hombres y <4.75 cm²/m² para mujeres, en concordancia con literatura previa [6,12]. - Variables analizadas:
• Demográficas: edad, sexo, IMC.
• Clínicas: comorbilidades (Charlson)., estadio tumoral (TNM 8ª edición), tipo de abordaje quirúrgico.
• Postoperatorias: complicaciones (Clavien-Dindo) [13].
• Oncológicas: supervivencia global (SG) y libre de enfermedad (SLE). - Análisis estadístico
Se emplearon pruebas de Chi-cuadrado para variables categóricas y U de Mann–Whitney para variables continuas.
SG y SLE se estimaron mediante curvas de Kaplan–Meier y se compararon con log-rank.
Se consideró estadísticamente significativo un valor de p<0.05.
Resultados
- Características basales
Se analizaron 65 pacientes (60% hombres) con edad media de 72 años. El 40% presentaba sarcopenia según TPAI. No se observaron diferencias significativas en el IMC ni en el índice de comorbilidad de Charlson entre grupos. - Estadificación tumoral y abordaje:
El grupo sarcopénico presentó mayor proporción de enfermedad en estadio avanzado (23% en estadio IV vs. 7%; p<0.01), hallazgos consistentes con otras series [4,10]. La cirugía laparoscópica fue menos frecuente en pacientes con sarcopenia (40% vs. 66%; p=0.04), posiblemente por mayor dificultad técnica o peor estado general [14]. - Complicaciones postoperatorias:
El 58% de los pacientes con sarcopenia presentó alguna complicación. Las más comunes fueron infecciones respiratorias e íleo postoperatorio. No hubo diferencias significativas en la tasa de complicaciones graves (Clavien ≥ III) (p=0.21), aunque sí se observó una tendencia al alza, como se ha documentado en otras cohortes [5,6,15]. - Supervivencia.
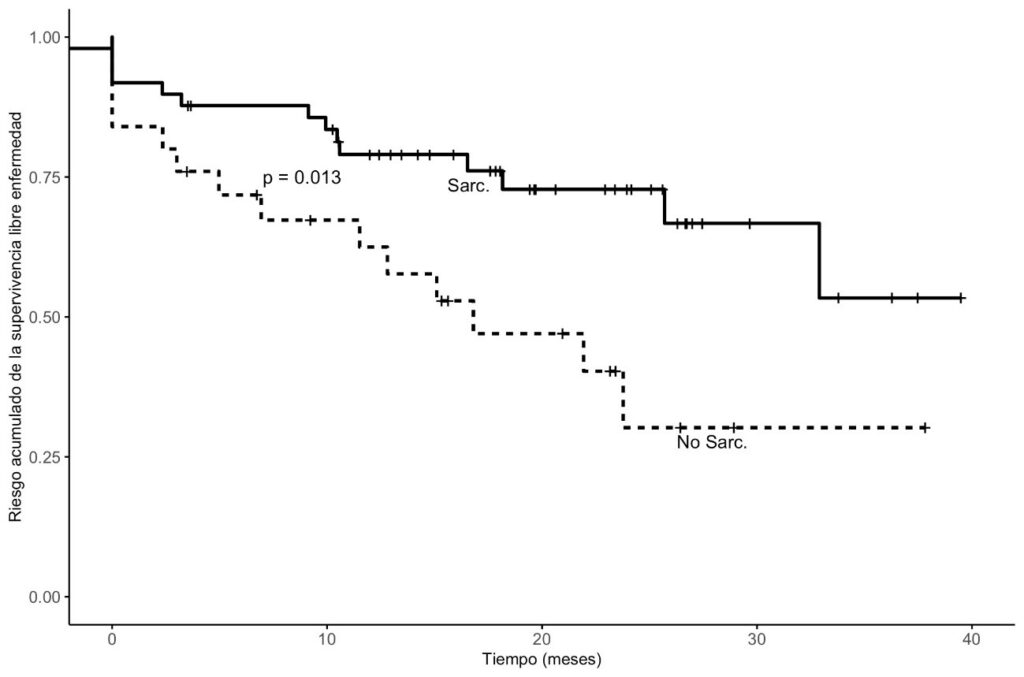
La supervivencia global fue significativamente menor en el grupo sarcopénico (mediana: 15 meses vs. 22 meses; p=0.013) (Gráfico 1). La supervivencia libre de enfermedad también fue inferior (12 meses vs. 18 meses), aunque sin significación estadística (p=0.013) (Gráfico 2.). Estos resultados refuerzan el valor del TPAI como marcador pronóstico [9,10,16].
Discusión
Los pacientes con sarcopenia presentaron enfermedad más avanzada al diagnóstico, menor acceso a abordajes mínimamente invasivos y menor supervivencia, lo que subraya el papel del músculo esquelético como centinela del estado funcional y pronóstico oncológico [3,4,11].
A diferencia del IMC, el TPAI permite discriminar la pérdida de masa muscular de forma más precisa, incluso en pacientes con normopeso o sobrepeso [7,12]. Por ello, su evaluación debería incorporarse en la valoración preoperatoria integral [17].
Nuestros hallazgos coinciden con revisiones sistemáticas que han demostrado que la sarcopenia aumenta el riesgo de mortalidad, complicaciones y estancia hospitalaria [4,5,10,16].
Entre las limitaciones del estudio destacan su diseño retrospectivo, el tamaño muestral relativamente reducido y la ausencia de datos sobre fuerza muscular o rendimiento físico (dimensiones funcionales de la sarcopenia). Sin embargo, el uso sistemático de TC, la homogeneidad del tratamiento quirúrgico y el seguimiento clínico fortalecen la validez interna.
Conclusiones
La sarcopenia, medida objetivamente mediante el índice del área del músculo psoas (TPAI), se asocia a enfermedad más avanzada y menor supervivencia en pacientes con cáncer gástrico sometidos a cirugía curativa.
Su evaluación preoperatoria podría optimizar la selección de candidatos quirúrgicos, la planificación de abordajes mínimamente invasivos y el diseño de estrategias de soporte nutricional y funcional personalizadas.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
Agradecimientos
Agradecemos al Servicio de Radiodiagnóstico del Hospital Universitario de Salamanca por su colaboración en la adquisición y análisis de imágenes.
Referencias
- Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2020: GLOBOCAN estimates. CA Cancer J Clin. 2021;71(3):209–249.
- Smyth EC, Nilsson M, Grabsch HI, et al. Gastric cancer. Lancet. 2020;396(10251):635–648.
- Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus. Age Ageing. 2019;48(1):16–31.
- Shachar SS, Williams GR, Muss HB, et al. Sarcopenia and survival in solid tumors: meta-analysis. Eur J Cancer. 2016;57:58–67.
- van Vugt JLA, Levolger S, Gharbharan A, et al. Impact of low skeletal muscle mass on outcome in cancer surgery. J Am Coll Surg. 2018;226(6):1080–1089.
- Sugiyama K, Narita Y, Mitani Y, et al. Preoperative psoas muscle index and surgical outcomes in gastric cancer. World J Surg Oncol. 2020;18(1):28.
- Prado CM, Baracos VE, McCargar LJ, et al. Body composition as prognostic in cancer patients. Am J Clin Nutr. 2007;85(6):1355–1363.
- Mourtzakis M, Prado CM, Lieffers JR, et al. A practical and precise approach to quantification of body composition in cancer patients. Appl Physiol Nutr Metab. 2008;33(5):997–1006.
- Reisinger KW, Bosmans JW, Uittenbogaart M, et al. Sarcopenia and outcomes after gastric cancer surgery. Ann Surg Oncol. 2015;22(11):3974–3981.
- Zhuang CL, Huang DD, Pang WY, et al. Sarcopenia as an independent predictor of outcomes after gastric cancer surgery. Am J Surg. 2016;211(3):584–591.
- Tan BH, Birdsell LA, Martin L, et al. Sarcopenia in cancer: impact on treatment tolerance. Ann Oncol. 2009;20(2):296–302.
- Martin L, Birdsell L, Macdonald N, et al. Cancer cachexia and skeletal muscle index. J Clin Oncol. 2013;31(12):1539–1547.
- Dindo D, Demartines N, Clavien PA. Classification of surgical complications. Ann Surg. 2004;240(2):205–213.
- Kudou K, Saeki H, Nakashima Y, et al. Influence of sarcopenia on surgical outcomes. Surg Today. 2020;50(12):1474–1481.
- Nishigori T, Tsunoda S, Akiyama Y, et al. Preoperative psoas muscle mass predicts surgical complications. World J Surg. 2016;40(9):2282–2289.
- Jang MK, Lee WJ, Lee YJ, et al. Sarcopenia as a predictor of postoperative complications. Gastric Cancer. 2021;24(4):948–957.
- Arango-Lopera VE, Arroyo P, Gutiérrez-Robledo LM, et al. Sarcopenia: implications for surgery. Nutr Hosp. 2013;28(5):1512–1521.
Ilustraciones
Gráfico 1: El gráfico muestra las curvas de supervivencia global (SG) estimadas mediante el método de Kaplan–Meier para los grupos con y sin sarcopenia. Se observa una diferencia significativa en la supervivencia entre ambos grupos. Los pacientes con sarcopenia presentan una mediana de SG de 15 meses, en comparación con 22 meses en el grupo no sarcopénico (p=0.013, prueba de log-rank).
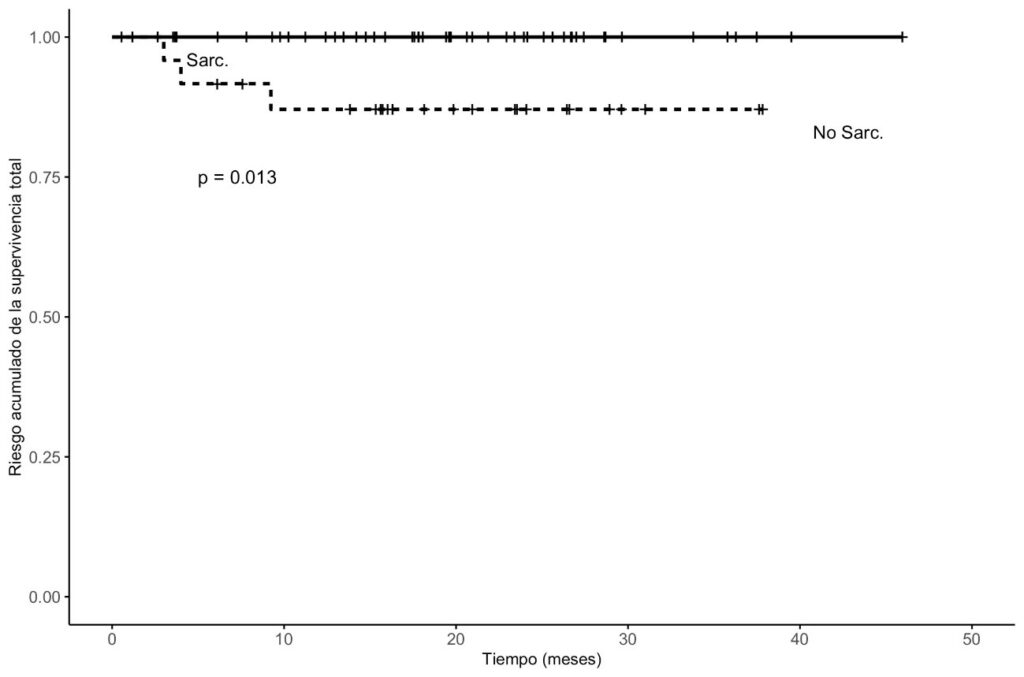
Gráfico 2: Este gráfico muestra las curvas de supervivencia libre de enfermedad (SLE) para ambos grupos, también mediante el método de Kaplan–Meier.Los pacientes con sarcopenia presentan una tendencia a menor SLE, con una mediana de 12 meses frente a 18 meses en el grupo sin sarcopenia. Aunque esta diferencia sugiere un impacto clínico potencial, no alcanzó significación estadística (p=0.013, log-rank).