NOTA CIENTÍFICA:
INUSUAL CASO DE LINFOMA ESPLÉNICO DE LA ZONA MARGINAL DIAGNÓSTICADO MEDIANTE ESPLENECTOMÍA
(UNUSUAL CASE OF SPLENIC MARGINAL ZONE LYMPHOMA DIAGNOSED BY SPLENECTOMY)
Alicia Aguado(1), Francisca Moreno(1), Belén Rodríguez(4), Marcela Olaya(2), A.M Montero(3), Ángel Martín Louredo(1).
Servicios de (1) Cirugía General y del Aparato Digestivo, (2) Anatomía Patológica y (3) Aparato Digestivo, Complejo Asistencial Universitario de Palencia, Palencia, España. (4) Servicio de Cirugía General y del Aparato Digestivo, Hospital Universitario Río Hortega, Valladolid, España.
Correspondencia: para contactar con el autor accionar aquí (Alicia Aguado).
Palabras clave: Linfoma no-Hodgkin, neoplasias esplénicas, linfoma de células B de la zona marginal, esplenectomía.
Descargar artículo en PDF
Introducción:
Los linfomas esplénicos de la zona marginal (LEZM) son neoplasias de las células B maduras infrecuentes, ya que constituyen menos del 5% de los linfomas no Hodgkin (LNH) según la clasificación de la Organización Mundial de la Salud (1).
Histológicamente, es característica, aunque no constante, la presencia de células B maduras de pequeño y mediano tamaño, con núcleos redondos u ovalados, cromatina condensada y prolongaciones polares formando los denominados linfocitos vellosos (2),(3).
Se desconoce el mecanismo patogénico, aunque se relaciona con la estimulación crónica por antígenos, siendo el más frecuente el virus de la hepatitis C (4),(5). Es relativamente frecuente su asociación con enfermedades autoinmunes como anemia hemolítica autoinmune, trombocitopenia autoinmune, enfermedad por aglutininas frías, anticoagulantes circulantes, enfermedad de Von Willebrand adquirida o angioedema como resultado de la deficiencia adquirida del inhibidor del C1. Su curso es indolente y se caracteriza por la infiltración de la médula ósea, el bazo y la sangre periférica. Se puede manifestar con esplenomegalia, linfocitosis, citopenias y la edad media de presentación son 65 años, sin preferencia de género, de razas ni de zonas geográficas. No suele generar adenopatías, a diferencia de otros linfomas.
Ante la sospecha se debe realizar un estudio de autoinmunidad: ANA, anti-DNA, anticuerpos antitiroideos, factor reumatoide, anticoagulantes circulantes (lúpico o cardiolipídico), factor de Von Willebrand adquirido y déficit de C1. El diagnóstico puede establecerse con la combinación de la clínica, la documentación de una morfología celular típica e inmunofenotipo de las células sanguíneas (cd20, bcl-2 e IgM con expresión variable de IgD) junto con la detección de infiltración intrasinusoidal por células CD20 (+) en la médula ósea (6). En una minoría de casos, es necesario una esplenectomía para llegar al diagnóstico definitivo.
Debido a la escasez de ensayos prospectivos aleatorios y la rareza de esta entidad, no hay un tratamiento estándar. Cuando el LEZM es asintomático, se prefiere una actitud expectante; por el contrario, cuando hay síntomas, existe un amplio abanico de posibilidades terapéuticas, que abarcan la inmunoterapia con Rituximab solo o en combinación con quimioterapia basada en análogos de las purinas o agentes alquilantes y excepcionalmente la cirugía en forma de esplenectomía (7).
Hasta ahora la conocida como HPLL/ABC parece ser la mejor escala para estratificar el pronóstico del LEZM, valorándose la hemoglobina, plaquetas, LDH y nódulos extrahiliares (8),(9). Existe otro índice pronóstico utilizado por el intergrupo italiano, pero no ha sido validado por el resto de los grupos.
Objetivos:
El objetivo de este trabajo es presentar un caso infrecuente de LEZM que no se diagnosticó definitivamente hasta la esplenectomía.
Caso clínico:
Varón de 60 años, caucásico, sin antecedentes personales de interés que consulta por pérdida ponderal de 5 kilos, edemas en ambas extremidades inferiores y sudoración nocturna.
Presenta buen estado general destacando a la exploración física, palidez de piel y mucosas, sin objetivarse adenopatías cervicales, supra-infraclaviculares o en otras localizaciones. Se palpa masa abdominal indurada y fija que impresiona abarcar hemiabdomen izquierdo hasta hipocondrio derecho y mesogastrio sin dolor ni datos de irritación peritoneal.
Analíticamente destaca pancitopenia con hemoglobina de 8,7 g/dl, plaquetas: 82 x 109/l y leucocitos: 1,2 x 109/l, presentando el resto de la analítica valores dentro de la normalidad. Las serologías de VIH, VHC y VHB resultaron negativas. Se objetivó, además, CA 125: 88,8 U/ml (0-35) y alteración del proteinograma con elevación de Alfa 1 globulinas y Beta2 microglobulina.
Los estudios complementarios que incluyeron biopsia de médula ósea, mielograma en sangre periférica, ecografía abdominal y TAC toraco-abdominal únicamente demostraron marcada esplenomegalia y dilatación del eje esplenoportal sin otros hallazgos patológicos, ni tan siquiera en el estudio histológico de la médula ósea (ver imagen 1).
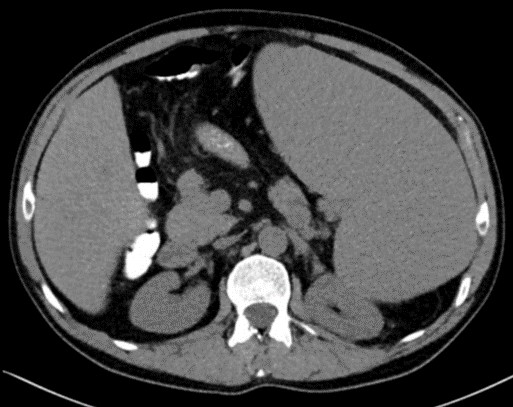
Imagen 1: TAC abdomino-pélvico: esplenomegalia gigante que condiciona un desplazamiento posterior del riñón izquierdo y del colon transverso. Dilatación de la vena porta y de la vena esplénica, calibre de 19 mm y 16 mm respectivamente.
Tras presentar el caso en el comité multidisciplinar correspondiente, se indicó esplenectomía con carácter diagnóstico dada la ausencia de afectación de la médula ósea, de adenopatías periféricas u otros signos de síndrome linfoproliferativo, que era la sospecha principal o al menos la más grave potencialmente.
Se pautó profilaxis antibiótica preoperatoria con Cefazolina 2 gramos. Dada la presencia de esplenomegalia masiva, es decir, un bazo mayor de 20 centímetros cuyo polo inferior llegaba hasta la pelvis se decidió realizar un abordaje abierto mediante laparotomía media supra e infraumbilical. No se evidenció diseminación intraperitoneal ni ascitis. El bazo ocupaba casi la totalidad del hemiabdomen izquierdo con una longitud aproximada de 30 centímetros. Se accedió al hilio esplénico a través de la transcavidad de los epiplones. En primer lugar, se individualizaron y se ligaron la arteria y la vena esplénica para evitar hemorragias dado el tamaño del bazo y su difícil manipulación. Se liberó el bazo de sus adherencias periesplénicas y se seccionaron los ligamentos gastroesplénico, esplenocólico y los vasos cortos. Por último, se realiza maniobra de rotación anterior del bazo sobre el hilio esplénico (maniobra de Gómez) y se comprueba la correcta hemostasia. No se deja drenaje (ver imagen 2). El tiempo operatorio fue de 1 hora y 40 minutos. No hubo complicaciones intraoperatorioas ni necesidad de transfusiones sanguíneas ni de plaquetas perioperatorias. El postoperatorio cursó sin incidencias; se pautó profilaxis antitrombótica con heparina de bajo peso molecular según pauta habitual de 0,5 mg/kg/día, profilaxis perioperatoria de la infección frente a cocos grampositivos encapsulados y se puso la vacuna antineumocócica. No presentó trombocitosis reactiva y fue dado de alta al 6 día postoperatorio.
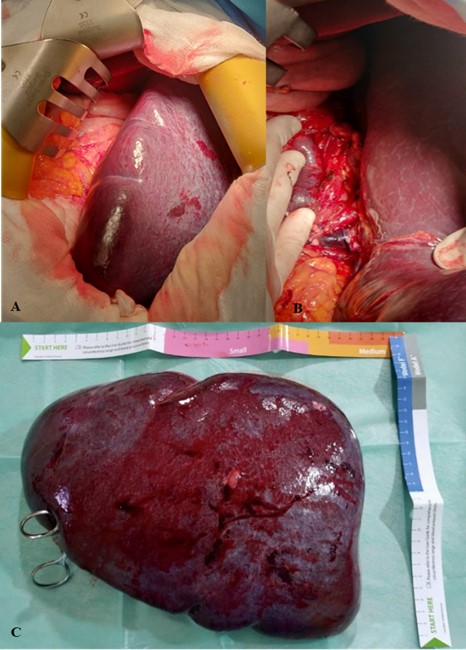
Imagen 2: Imágenes quirúrgicas. A) Esplenomegalia gigante. B) Se observa en el hilio esplénico, vena esplénica de gran calibre. C) Bazo gigante de 32 x 24 x 9 cm de dimensiones.
Macroscópicamente, el bazo tenía unas dimensiones de 32 x 24 x 9 cm y pesaba 3.163 gramos. Externamente la cápsula era lisa, brillante y presentaba cambios granulares blanquecinos. La histopatología demostró expansión de la pulpa blanca-zona marginal e infiltración linfoide intrasinusoidal e intersticial de pulpa roja por linfocitos de mediano tamaño. También se confirmó la infiltración de los ganglios linfáticos del hilio esplénico. El estudio inmunohistoquímico confirma el diagnóstico de LEZM ya que muestra expresión de CD20, BCL2, y IgD en las células de la zona marginal e intrasinusoidal, siendo negativos el CCND1 y BCL6 (ver imagen 3).
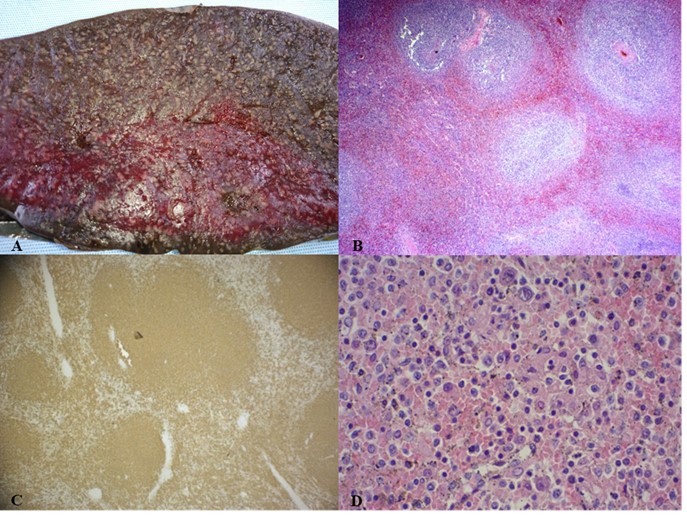
Imagen 3: Imágenes anatomo-patológicas. A) Corte macroscópico del bazo donde se observa afectación micronodular del parénquima. B) HE (Hematoxilina/eosina) 4X: se observa alteración de la morfología esplénica normal con ampliación de la zona marginal hacia el centro folicular y hacia la pulpa roja. C) CD20 10X: se observa como los linfocitos que distienden la zona marginal son marcados de forma positiva con CD20/CD45ra/BCL-2. D) HE 20X: infiltración de linfocitos atípicos pequeños en la zona del manto y linfocitos medianos con citoplasma pálido y núcleo claro ovalado en la zona marginal, lo que conduce a un patrón de afectación mixto de la zona del manto y la zona marginal.
El paciente tenía un riesgo intermedio según el HPLL/ABC score. Ha presentado buena evolución clínica posterior, permaneciendo asintomático y sin necesidad de tratamiento médico ni oncológico activo. Al haber realizado una esplenectomía diagnóstica y terapéutica se hizo seguimiento clínico y analítico cada seis meses sin solicitar pruebas de imagen dada la ausencia de síntomas. Tras 42 meses de seguimiento permanece sin signos de recaída del linfoma.
Discusión:
El LEZM es un linfoma de células B de bajo grado, cuya incidencia es menor del 5% de los linfomas no Hodgkin. Suele estar diseminado al diagnóstico, comprometiendo la médula ósea y asociando citopenias. Existe un compromiso de la sangre periférica, hígado y los ganglios linfáticos localizados en el hilio esplénico, sin afectar estaciones ganglionares periféricas salvo en casos de transformación a linfoma de alto grado que ocurre en torno al 10-20% de los casos (10).
Habitualmente son asintomáticos y su diagnóstico es en la edad adulta. Una forma de debut es la esplenomegalia, pudiendo presentar dolor abdominal (11) o anemia y trombopenia secundarias al hiperesplenismo.
Macroscópicamente se observa un crecimiento a expensas de múltiples nódulos linfoides grisáceos y de pequeño tamaño, existiendo un aumento de la pulpa blanca. Microscópicamente hay afectación de la zona del manto mixto y la zona marginal. Las células son de tipo centrocito, monocitoides o linfoplasmocíticas con menos del 20% de inmunoblastos, siendo un hallazgo relativamente específico la infiltración intrasinusoidal de la médula ósea (10).
Inmunohistoquímicamente expresan marcadores de fenotipo B (CD20, CD19, CD79a), salvo CD5, CD10 y CD23 y además expresan bcl-2 e IgM con expresión variable de IgD (positiva en los linfocitos esplénicos de la zona marginal) y CD43 (12).
Para el estudio inicial es relevante una buena historia clínica, exploración física, biopsia de médula ósea, pruebas de imagen, analítica, serología de virus de la hepatitis C e inmunofenotipo. La esplenectomía es una opción diagnóstica cuando el diagnóstico no se alcanza mediante las pruebas convencionales, como ocurre en el presente caso.
La cirugía consiste en la exéresis completa del bazo porque se necesita una pieza quirúrgica íntegra para el correcto estudio anatomopatológico y en la mayoría de los casos tiene un carácter terapéutico ya que resuelve el hiperesplenismo y controla los síntomas derivados de la esplenomegalia. Cuando hay una esplenomegalia masiva o una patología maligna el abordaje abierto es una opción válida y el abordaje laparoscópico no es una contraindicación formal, aunque si se asocia con mayor tiempo quirúrgico, mayor número de trócares, mayor tasa de conversión a cirugía abierta y a veces son necesarias incisiones accesorias amplias para la extracción íntegra de la pieza quirúrgica, si no se puede extraer fragmentado (debe consultarse con hematología y Anatomía Patológica antes de fragmentar un bazo).
La esplenectomía está asociada a unas complicaciones postoperatorias específicas: lesión inadvertida de la cola de páncreas que puede prevenirse con una disección minuciosa y adecuada, así como con el uso de endograpadoras; complicaciones hemorrágicas que pueden tener origen en los vasos gástricos cortos, vasos polares de pequeño tamaño o hilio esplénico; y complicaciones infecciosas, fundamentalmente respiratorias y abscesos subfrénicos. También hay que tener en cuenta el riesgo de trombosis portoesplénica postoperatoria que es mayor en los pacientes con síndromes linfoproliferativos; el riesgo de trombocitosis reactiva y el mayor riesgo de sepsis por bacterias encapsuladas, siendo el neumococo el más frecuente.
Hay parámetros clínicos asociados con un peor pronóstico, como el desarrollo de adenopatías, aumento de β2-microglobulina, leucocitosis, linfopenia o linfocitosis, anemia, trombocitopenia, uso de quimioterapia, estado funcional ECOG ≥2, respuesta incompleta a tratamiento, edad avanzada o patrón difuso de infiltración de médula ósea (13).
El diagnóstico diferencial debe plantearse con: leucemia linfática crónica tipo B, tricoleucemia, el linfoma linfoplasmacítico y la linfocitosis policlonal persistente de células B (14), aparte de otras causas de esplenomegalia cuando ésta sea la única manifestación (ver tabla 1).
| CAUSAS | PATOLOGÍAS |
| Infecciosas | Hepatitis, endocarditis, tuberculosis, virus Epstein-Barr, paludismo, brucellosis, sífilis. |
| Inflamatorias | Sarcoidosis, amiloidosis, artritis reumatoide, lupus eritematoso sistémico, síndrome de Felty. |
| Congestivas | Cirrosis, trombosis, malformaciones o tumores vasculares, trombosis vena esplénica, porta o suprehepáticas. |
| Hematológicas |
Leucemia (mieloide crónica, linfoide crónica), linfoma, policitemia vera, trombocitopenia, mielofibrosis, esferocitosis, enzimopatía eritrocítica. Hemoglobinopatías: talasemia mayor, anemia hemolítica. |
| Enfermedad por depósito | Enfermedad de Gaucher. Niemann-Pick, enfermedad de Letterer-Siwe. |
| Traumatismo | Hematomas |
| Estructural | Metástasis esplénicas, abscesos, tumoraciones de origen no vascular: fibrosarcomas, lipomas, hamartomas y quistes. |
Tabla 1: Patologías que generan esplenomegalia aislada agrupadas por bloques de causas.
En la mayoría de los casos se toma una actitud expectante hasta la aparición de síntomas sistémicos, citopenias severas o enfermedad nodal agresiva, momento en el que se inicia tratamiento (15). Las opciones terapéuticas para LEZM son amplias e incluyen esplenectomía, quimioterapia e inmunoterapia con Rituximab solo o asociado a quimioterapia. Además, hay que considerar erradicar el VHC con tratamientos antivirales cuando se asocia al LEZM. La esplenectomía es eficaz y segura realizándose en los casos de pacientes jóvenes, esplenomegalia sintomática o citopenias severas (16). La piedra angular del tratamiento es el anticuerpo monoclonal anti-CD20, Rituximab, ya que produce una respuesta rápida erradicando la enfermedad a nivel molecular, presenta una alta tasa de respuesta general (>80%) y tiene una toxicidad mínima. Es una terapia de primera línea razonable para pacientes sin enfermedad diseminada que necesitan tratamiento y para pacientes con contraindicaciones para la cirugía. Otra opción, es combinar el Rituxumab con quimioterapia basada en ciclofosfamida, vincristina, doxorrubicina y prednisona (R-COMP) o con bendamustina (BR). Se suele indicar en pacientes con enfermedad diseminada, síntomas constitucionales y/o signos de transformación de alto grado.
Hay varios índices pronósticos para el LEZM. Destacan el índice promovido por el intergrupo de linfoma intaliano pero no está validado por el resto de grupos y el más utilizado que es el HPLL/ABC. Este sistema simplificado de estratificación pronóstica incluye varios factores: hemoglobina < 9.5 g/dL, plaquetas <80 x103/μL, LDH elevada por encima del valor normal y adenopatías fuera del hilio esplénico e hilio hepático palpables o demostradas por prueba de imagen. Todos los factores tienen el mismo peso: un punto por cada factor adverso. Se divide en tres grupos de riesgo: el grupo A, riesgo bajo: 0 puntos, el grupo B, riesgo intermedio: 1-2 puntos y el grupo C, riesgo alto: 3-4 puntos.
La mayoría de los pacientes muestran un curso indolente con una supervivencia media de aproximadamente 8 a 10 años. La mortalidad global tras realizar una esplenectomía diagnóstica en linfomas esplénicos es baja, como se demuestra en la revisión reciente realizada por Fallah et al. donde se observa que el 58% de los pacientes de su estudio fueron tratados con esplenectomía, con una mortalidad global de treinta días del 4% (17).
La rareza de esta enfermedad y su escasa sintomatología al inicio representan un reto diagnóstico y quirúrgico y hacen difícil tener un alto índice de sospecha. Un reto para el futuro es identificar aquellos pacientes que se puedan beneficiar de enfoques diagnósticos y tratamientos novedosos basados en aspectos moleculares que estudian mutaciones de genes, mejorando así el pronóstico clínico y biológico de esta enfermedad.
Conclusiones:
El linfoma esplénico de la zona marginal es una entidad hematológica infrecuente, de aparición en la edad adulta y curso indolente.
Se manifiesta de forma característica con esplenomegalia, linfocitosis y citopenias. El diagnóstico se basa en la histología del bazo o de la médula ósea, el inmunofenotipo y la clínica.
En la mayoría de los casos se toma una actitud expectante hasta la aparición de síntomas, momento en el que se inicia tratamiento. La piedra angular del tratamiento es el Rituximab que puede ir asociado a quimioterapia. La esplenectomía es eficaz y segura realizándose en los casos de esplenomegalia sintomática o citopenias severas.
La rareza de esta enfermedad y su escasa sintomatología al inicio presenta un reto diagnóstico y quirúrgico.
Declaraciones y conflicto de intereses: El manuscrito enviado ha sido revisado y aprobado por todos los autores para su publicación y no tiene conflicto de intereses con la revista ACIRCAL y/o con la industria. Además, no ha sido publicado previamente, ni ha sido sometido simultáneamente a valoración para publicación en otras revistas ni órganos editoriales.
Referencias bibliográficas:
- Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, Advani R, Ghielmini M, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. 2016 May 19;127(20):2375-90. doi: 10.1182/blood-2016-01-643569. Epub 2016 Mar 15. PMID: 26980727; PMCID: PMC4874220.
- Piris MA, Onaindía A, Mollejo M. Splenic marginal zone lymphoma. Best Pract Res Clin Haematol. 2017 Mar-Jun;30(1-2):56-64. doi: 10.1016/j.beha.2016.09.005. Epub 2016 Nov 5. PMID: 28288718.
- Vannata B, Stathis A, Zucca E. Management of the marginal zone lymphomas. Cancer Treat Res. 2015; 165:227-49. doi: 10.1007/978-3-319-13150-4_9. PMID: 25655612.
- Rosand CB, Valla K, Flowers CR, Koff JL. Effective management strategies for patients with marginal zone lymphoma. Future Oncol. 2018 May;14(12):1213-1222. doi: 10.2217/fon-2017-0480. Epub 2017 Dec 20. PMID: 29260925; PMCID: PMC5992567.
- Perrone S, D’Elia GM, Annechini G, Pulsoni A. Infectious Aetiology of Marginal Zone Lymphoma and Role of Anti-Infective Therapy. Mediterr J Hematol Infect Dis. 2016 Jan 1;8(1): e2016006. doi: 10.4084/MJHID.2016.006. PMID: 26740867; PMCID: PMC4696464.
- Arcaini L, Rossi D, Paulli M. Splenic marginal zone lymphoma: from genetics to management. 2016 Apr 28;127(17):2072-81. doi: 10.1182/blood-2015-11-624312. Epub 2016 Mar 17. PMID: 26989207.
- Bonnet C, Lejeune M, Van Kemseke C, Bron D, Beguin Y. Prise en charge actueLe du lymphome de la zone marginale [Current management of marginal zone lymphomas]. Rev Med Suisse. 2015 Aug 26;11(483):1549-56. French. PMID: 26502581.
- Lenglet J, Traullé C, Mounier N, Benet C, Munoz-Bongrand N, Amorin S, et al. Long-term follow-up analysis of 100 patients with splenic marginal zone lymphoma treated with splenectomy as first-line treatment. Leuk Lymphoma. 2014 Aug;55(8):1854-60. doi: 10.3109/10428194.2013.861067. Epub 2014 May 6. PMID: 24206091.
- Montalbán C, Abraira V, Arcaini L, Domingo-Domenech E, Guisado-Vasco P, Iannitto E, et al. Splenic Marginal Zone Lymphoma Study Group (SMZLSG). Simplification of risk stratification for splenic marginal zone lymphoma: a point-based score for practical use. Leuk Lymphoma. 2014 Apr; 55(4):929-31. doi: 10.3109/10428194.2013.818143. Epub 2013 Jul 29. PMID: 23799931.
- Sangle N. Splenic marginal zone B cell lymphoma. PathologyOutlines.com website. http://www.pathologyoutlines.com/topic/lymphomasplenicmzl.html.
- Hall DJ, Dang NH, Shaw CM. Successful Surgical Removal of the Largest Known Spleen. Case Rep Surg. 2020 Feb 25; 2020:6790808. doi: 10.1155/2020/6790808. PMID: 32158587; PMCID: PMC7061101.
- SEAP-SEHH-GOTEL. Recomendaciones para el estudio histopatológico, Inmunohistoquímico, citogenético y molecular e Informe diagnóstico de los procesos neoplásicos Linfoides. 2015 CONSENSO.
- Starr AG, Caimi PF, Fu P, Massoud MR, Meyerson H, Hsi ED, et al. Splenic marginal zone lymphoma: excellent outcomes in 64 patients treated in the rituximab era. 2017 Aug;22(7):405-411. doi: 10.1080/10245332.2017.1279842. Epub 2017 Jan 20. PMID: 28105889.
- Santos TSD, Tavares RS, Farias DLC. Splenic marginal zone lymphoma: a literature review of diagnostic and therapeutic challenges. Rev Bras Hematol Hemoter. 2017 Apr-Jun;39(2):146-154. doi: 10.1016/j.bjhh.2016.09.014. Epub 2016 Dec 22. PMID: 28577652; PMCID: PMC5457460.
- Joshi M, Sheikh H, Abbi K, Long S, Sharma K, Tulchinsky M, Epner E. Marginal zone lymphoma: old, new, targeted, and epigenetic therapies. Ther Adv Hematol. 2012 Oct; 3(5):275-90. doi: 10.1177/2040620712453595. PMID: 23616915; PMCID: PMC3627321.
- Pata G, Bartoli M, Damiani E, Solari S, Anastasia A, Pagani C, Tucci A. Still a role for surgery as first-line therapy of splenic marginal zone lymphoma? Results of a prospective observational study. Int J Surg. 2017 May;41: 143-149. doi: 10.1016/j.ijsu.2017.03.077. Epub 2017 Mar 30. PMID: 28366762.
- Fallah J, Olszewski AJ. Diagnostic and therapeutic splenectomy for splenic lymphomas: analysis of the National Cancer Data Base. Hematology. 2019 Dec;24(1):378-386. PMID: 30885066; PMCID: PMC6425967.
